Determinar la frecuencia de factores de riesgo cardiometabólico (FRC) en niños y adolescentes con síndrome de Down y establecer su relación con indicadores de composición corporal. Este estudio de tipo transversal descriptivo, desarrollado entre 2015-2016, en la ciudad Mérida, Venezuela, incluyó a 54 individuos con síndrome de Down menores de 18 años, Los FRC investigados fueron, sobrepeso-obesidad, hipertensión arterial (HTA), sedentarismo, dislipidemia e hiperglucemia; los indicadores de composición corporal, circunferencia de cintura, área grasa, pliegues tricipital, suprailíaco y subescapular, y los índices de cintura/talla, SESTRI, conicidad y centripetalidad. Presentaron uno o más FRC 75,9%, y entre los más frecuentes fueron dislipidemia 59,3%, sedentarismo 45,2% y Pre-HTA/HTA 24,1%. Hubo una elevada frecuencia de circunferencia de cintura alta 75,9%, índice cintura/talla alto 74%, área grasa alta 92,6% e índice de conicidad alto 46,3%. Se observaron correlaciones positivas significativas de la presión arterial sistólica, diastólica y negativas del CHDL, con la circunferencia de cintura (r=0,710; r=0,657; r=-0,423, respectivamente; p=0,0001), con el pliegue tricipital (r=0,346, r=0,380; r=-0,362, respectivamente, p<0,01) y con el índice de conicidad (r=0,333, r=0,616, r=-0412, respectivamente p<0,01). El CHDL bajo fue más frecuente en sujetos del área urbana en comparación con la rural (60 % vs 31,6 %; p=0,046).La prevalencia de FRC en niños y adolescentes con síndrome de Down es mayor que la reportada en la población sin esta entidad genética, y los indicadores de adiposidad se correlacionaron con los FRC. Estos deben ser detectados a temprana edad para disminuir enfermedades crónicas degenerativas en edad adulta. An Venez Nutr 2019; 32(1): 4-12.
Palabras clave: Síndrome de Down, factores de riesgo cardiometabólico, dislipidemias, composición corporal.
To determine the frequency of cardiometabolic risk factors (CRF) in children and adolescents with Down syndrome and establish their relationship with body composition indicators. A descriptive cross-sectional investigation was carried out between 2015-2016 in Mérida, Venezuela, with 54 individuals with Down syndrome. The CRF investigated were overweight-obesity, hypertension, sedentary lifestyle, dyslipidemia and hyperglycemia. Body composition indicators investigated were waist circumference, fat area, triceps, suprailiac and subscapular folds, and waist/height, SESTRI, conicity and centripetality indices. The 75.9% presented one or more CRF, the most frequent were dyslipidemia 59.3%, sedentary lifestyle 45.2% and pre-hypertension and hypertension 24.1%. There was a high frequency of high waist circumference 75.9%, high waist/height index 74%, high fat area 92.6% and high conicity index 46.3%. Significant positive correlations of systolic, diastolic and negative of HDL-C were observed, with waist circumference (r = 0.710, r = 0.657, r = -0.423 respectively, p = 0.0001), with the triceps fold (r = 0.346, r = 0.380, r = -0.362 respectively, p <0.01) and with the conicity index (r = 0.333, r = 0.616, r = -0412 respectively p <0.01). Low HDL-C was more frequent in urban subjects compared to rural subjects (60% vs 31.6%, p = 0.046).The prevalence of CRF in children and adolescents with Down syndrome is higher than that reported in the population without this genetic entity, and the indicators of adiposity were correlated with CRF. These must be detected at an early age to reduce chronic degenerative diseases in adulthood. An Venez Nutr 2019; 32(1): 4-12.
Key words: Down syndrome, cardiometabolic risk factors, dyslipidemias, body composition.
Solicitar copia a: Carlos Enrique Ramos Urrea, e-mail: carlosramos2690@gmail.com
El síndrome de Down (SD) es la causa genética más común de discapacidad intelectual, y el trastorno cromosómico viable más frecuente (1). Es causado por la trisomía total o parcial del cromosoma 21(2). En Venezuela, según el Estudio Colaborativo Latinoamericano de Malformaciones Congénitas, durante los años 1998 a 2005, la incidencia fue de 1 en cada 671 nacidos vivos (3), 1 en 1.100 en Australia (4), 1 en 691-792 en los Estados Unidos (1,5), 1 en 400 en Chile (5), y 1 en 319 en Emiratos Árabes Unidos (6). La incidencia mundial global es de aproximadamente 1,25-1,67 por 1000 nacidos vivos (7), con 5 millones de casos en todo el mundo (8).
La esperanza de vida continúa en aumento (3), desde aproximadamente 9 años en 1929 hasta más de 60 años en la actualidad (5,9). Esto es debido al mejor conocimiento científico de la entidad, avances en prevención, diagnóstico, manejo de sus potenciales comorbilidades, y complicaciones (5,10). Sin embargo, la exposición a nuevos factores ambientales hace que en la actualidad no se conozca el riesgo cardiovascular real de estos individuos (5).
El SD se caracteriza clínicamente por presentar rasgos dismórficos distintivos que conducen al reconocimiento al momento de nacer, hipotonía, hipermovilidad articular, alteraciones oculares, hipoacusia, cardiopatías congénitas, trastornos gastrointestinales, anomalías hematológicas (11), dislipidemias (3,5,12), hipotiroidismo (4,11), diabetes mellitus tipo 1(13), y disminución de la densidad mineral ósea(14), entre otros. Los niños y adolescentes desarrollan con mayor frecuencia sobrepeso (5,15), obesidad (5,10,14), alteraciones en el índice de masa corporal (IMC), que pueden limitar la realización de actividades físicas (10,15) y contribuir a un mayor riesgo de enfermedad cardiovascular (5,10). No obstante, presentan un menor riesgo de hipertensión arterial (13).
Para alcanzar una adecuada salud cardiovascular, se debe realizar prevención primaria y primordial para evitar la presencia de los factores de riesgo cardiometabólico (FRC). La asociación de estos factores y de la obesidad en niños y adolescentes, puede conllevar a marcadores subclínicos de aterosclerosis, mayor riesgo coronario y a mortalidad prematura en la vida adulta (16).
Por lo tanto, identificar los FRC en pacientes con SD, especialmente durante la infancia es necesario. No obstante, existe información limitada en la prevalencia y la contribución de estos factores de riesgo en la morbilidad y mortalidad cardiovascular en los individuos con SD (17).
El objetivo del presente estudio es determinar la frecuencia de FRC en individuos menores de 18 años con SD, y establecer su asociación con indicadores de composición corporal.
Estudio transversal de tipo descriptivo que incluye individuos con SD, evaluados en el Servicio de Nutrición, Crecimiento y Desarrollo, y la Unidad de Genética Médica de la del Instituto Autónomo Hospital Universitario de Los Andes, en los años 2015-2016, en Mérida, Venezuela.
Este estudio lo conformaron un total de 54 individuos con diagnóstico citogenético de SD variante trisomía libre, que acudieron a la consulta de la institución anteriormente citadas sin previa evaluación, menores de 18 años. Aunque fueron igualmente estudiados, se excluyeron de esta investigación aquellos con estudio citogenético de SD tipo mosaico y translocación, los que presentaban leucemia u otro tipo de cáncer, dislipidemias, diabetes, HTA, hipotiroidismo no controlado, o que se encontraban en postoperatorio inmediato o mediato por alteración cardiaca, gastrointestinal y hernias.
La edad cronológica se determinó en años, meses y días y la edad decimal en años para la fecha de evaluación. Se categorizó en grupos a los lactantes (<2 años), los niños (2 - 9 años) y los adolescentes (10 - 17 años).
Para el peso y la talla se utilizaron los valores de referencia por edad y sexo de acuerdo con tablas específicas para el SD (18). Al igual que para el IMC (19).
Para la circunferencia media del brazo izquierdo (CMBI), el pliegue tricipital izquierdo (PTr), y el pliegue subescapular izquierdo (PSe), los valores de referencia fueron los del estudio transversal de Caracas FUNDACREDESA (20). Para el pliegue suprailíaco, los valores de referencia usados fueron los de la población venezolana (21), y para la circunferencia de cintura se usaron las tablas de medición para la población de niños y adolescentes del Estado Zulia, Venezuela (22).
Por su parte, el área grasa (AG) se calculó usando los valores de PTr y CMBI en milímetros, utilizando la siguiente fórmula:
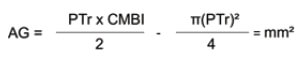
Y para este indicador se utilizaron los valores de referencia por edad y sexo según las tablas de FUNDACREDESA, 1993 (23).
Para estimar el patrón de distribución de la grasa se construyeron los siguientes indicadores, el índice cintura-talla (IC/T) con punto de corte que identifica el factor de riesgo cardiovascular en 0,50 en ambos sexos (24). El índice de SESTRI (IS) que resultó de dividir el valor del PSe entre el valor del PTr, ambos en milímetros, y el índice de centripetalidad (IC) que se calculó utilizando la siguiente fórmula:
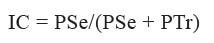
Para los IS y IC se utilizaron los valores de referencia por edad y sexo obtenidos del Proyecto Venezuela, con los siguientes puntos de corte: IS: alto > +2 DE (≥ 1 más acúmulo de grasa en el tronco) y normal ≤ +2 DE, y el IC: alto > +2 DE (≥ 56 obesidad central), normal ≤ +2 DE (25).
El índice de conicidad (ICO) se calculó con la fórmula de Valdez et al (26).
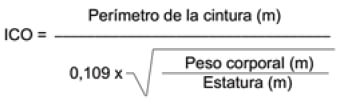
Teniendo en cuenta que el valor de referencia es 0-1 (forma de cilindro) y > 1,73 (forma de cono)(27).
Entre las variables clínicas se estudiaron la presión arterial sistólica (PAS) y diastólica (PAD), La tensión arterial (TA) se tomó mediante esfigmomanómetro automático por personal entrenado, repitiendo la medida hasta en tres ocasiones en el caso de valores de TA alta, registrando en este caso la media. La medición se realizó en el brazo derecho del niño sentado durante cinco minutos con la espalda apoyada y la fosa cubital a nivel del corazón, y se tomaron como valores de referencia de acuerdo con las recomendaciones internacionales en caso de síndromes específicos donde se ajustan los valores de TA a la talla (28).
Entre las variables bioquímicas como FRC, se consideró hiperglucemia si las concentraciones séricas de glucemia en ayunas eran ≥ 100 mg/dL; para el triglicérido sérico y el colesterol total se utilizaron los valores internacionales por grupo de edad (29), para el colesterol de lipoproteínas de baja densidad (C-LDL) se utilizaron los puntos de corte: alto, mayor de 130 mg/dL y normal menor e igual 130 mg/dL, y para los valores séricos del colesterol de la lipoproteína de alta densidad (C-HDL), se consideró: bajo menor de 40 mg/dL y normal mayor e igual a 40 mg/dL (21). Previo ayuno de 12 horas, se obtuvieron muestras de sangre de la vena antecubital y se colectaron en tubos vacutainer. Los niveles séricos de los parámetros bioquímicos de rutina como glucemia, colesterol total, triglicéridos, y C-HDL, se determinaron por métodos enzimáticos colorimétricos empleando kits comerciales (Human Gesellschaft fur Biochemica und Diagnostica mbH), utilizando un analizador automatizado modelo BT 3000. El colesterol de las lipoproteínas de baja densidad (LDL-c), se calculó a partir de la ecuación de Friedewald: LDL-c =Ct-(TAG/5)-HDL-c y el colesterol de las lipoproteínas de muy baja densidad (VLDL-c) mediante la fórmula TAG/517.
El sedentarismo se definió como la realización de actividad física durante menos de 15 minutos y menos de tres veces por semana durante el último trimestre (30). El estrato socioeconómico se determinó por el método Graffar modificado por Méndez Castellano (31).
El protocolo de la investigación fue evaluado por el Comité de Ética de la institución, el cual, evaluó su diseño y las normas establecidas por: el Código de Deontología Médica de Venezuela, Código de Bioética y Bioseguridad y la Declaración de Helsinki sobre principios éticos para investigaciones médicas en seres humanos.
Respetando la autonomía individual, a cada uno se le informó los objetivos de la investigación, la importancia de su cooperación voluntaria, el tipo de información que deben suministrar, las incomodidades que pueden causarle, la manera como se utilizarían los resultados de la investigación, y la posibilidad de retirarse cuando así lo deseen. Esta información fue suministrada al representante legal del participante a través de un formato de consentimiento informado, el cual fue firmado, junto el entrevistador y al menos un testigo.
Las variables cualitativas se presentaron en números absolutos y porcentajes y las cuantitativas en media y desviación estándar. Se determinó la frecuencia absoluta y porcentual de los FRC. La asociación entre la frecuencia de FRC y las alteraciones en los índices antropométricos se determinó mediante la aplicación del chi cuadrado. Se realizó una matriz de correlación de Pearson entre las variables cuantitativas que miden índices de composición corporal y los FRC. Se usó el Statistical Package for the Social Sciences, SPSS 23,0 para Windows y se consideró significativa una p<0,05.
Se estudiaron un total de 54 individuos y fueron excluidos 16 individuos que presentaban estudio citogenético de SD tipo mosaico y translocación, leucemia, postoperatorio mediato por alteración cardiaca.
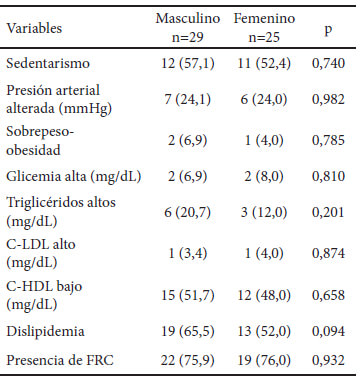
Entre las características demográficas de la población en estudio, 29 (53,7%) fueron del sexo masculino. La edad promedio fue de 6,20 ± 4,91 años. El grupo etario de niños entre los 2 a 10 años, estuvo comprendido por 31 (57,5%), seguido por el de lactantes 12 (22,2%) y el de adolescente 11 (20,4%). Fueron procedentes de áreas urbanas 35 (64,8%). La condición socioeconómica predominante fue el estrato III (Estrato medio bajo) con 32 (59,3%), seguido del estrato IV (Estrato Obrero) con 17 (31,5%) y del estrato I (Alto) (9,3%).
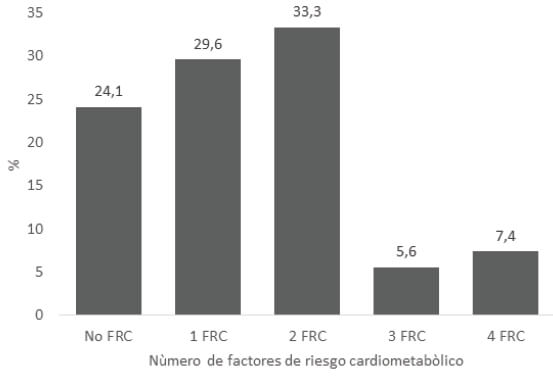
Presentaron uno o más FRC 75,9%, siendo la dislipidemia la más frecuente 59,3%, con C-HDL bajo en 50%. El sedentarismo estuvo presente en 46,2%, variable medida en los niños mayores de dos años, y la presión arterial alterada en 24,1%; (preHTA (20,9%) HTA (3,2%). Se observó hiperglucemia de ayuno en el 7,4% y con IMC por encima de los valores normales en el 5,6% (Sobrepeso (3,7%), obesidad (1,9%)). Figura 1. La distribución en el número de FRC se muestra en la figura 2, el 33,3% tuvo 2 FRC, el 29,6% 1 FRC, el 7,4% 4 FRC y el 5,6% tuvo 3 FRC.
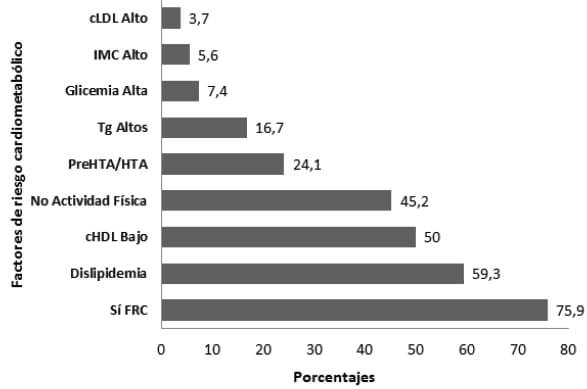
La presencia de FRC no estuvo asociada al sexo en forma significativa. La dislipidemia fue mayor en el sexo masculino 65,5%, siendo más frecuente la disminución del C-HDL en ambos sexos, Cuadro 1. Tampoco se observó asociación entre los FRC y los grupos de edad o la condición socioeconómica. En relación con la procedencia, solo se observó una frecuencia significativamente mayor de C-HDL bajo en el grupo del área urbana en comparación al área rural 60% vs 31,6% (p=0,046).
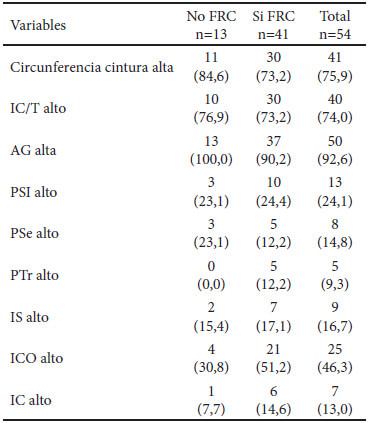
En el Cuadro 2, se presenta la frecuencia de alteración de los indicadores de composición corporal de acuerdo con la presencia o no de FRC. Se observó que los indicadores que mostraron una alta frecuencia de individuos sobre la norma fueron el área grasa 92,6%, la circunferencia de cintura 75,9% y el IC/T 74%, mientras que la alteración en el pliegue suprailíaco, PSe, PTr, IS y el IC presentaron una frecuencia baja. Los índices de composición corporal no fueron diferentes por sexo y, no se encontró asociación significativa con la presencia o no de FRC.
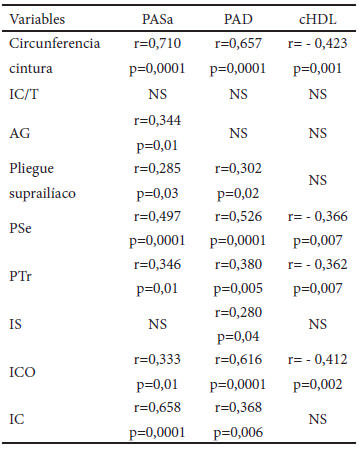
Dentro de los FRC estudiados, los que mostraron alguna correlación significativa estadísticamente con los diferentes indicadores de composición corporal estudiados fueron PAS, PAD y C-HDL, Cuadro 3. La circunferencia de cintura mostró una alta correlación positiva con PAS y PAD, e inversa con C-HDL (p=0,0001). PSe, PTr y el ICO también mostraron correlación positiva con PAS y PAD e inversa con el C-HDL (p<0,05), aunque de menor significancia que la cintura. El pliegue suprailíaco tuvo una correlación poco importante con PAS y PAD, así como el IC, éste último más significativo. El IS solo guardó una leve relación con la PAD. El AG mostró una correlación positiva moderada con la PAS.
Se ha considerado históricamente que el SD tiene un bajo riesgo de enfermedad ateroesclerótica (5,12,16), a menudo descrito como un modelo libre de ateroma (12,16). Mejoras en la atención médica han dado lugar a un marcado aumento en la esperanza de vida en personas con esta entidad (12,16), pero el riesgo elevado de obesidad, resistencia a la insulina y diabetes mellitus puede incrementar a largo plazo los riesgos de enfermedad cardiovascular aterosclerótica (12). Dos estudios diferentes realizados en Suecia-Dinamarca y California, mostraron que estos individuos presentan aproximadamente cuatro veces más riesgo de mortalidad por cardiopatía isquémica que la población general (32,33). Entre las causas de muerte en los individuos con SD entre los años 1969-2003 en Suecia, la neumonía fue la más frecuente, se evidenció disminución de los defectos cardiacos congénitos y la muerte por aterosclerosis, aunque infrecuente, fue más común que lo reportado anteriormente (34), por lo que el riesgo cardiovascular real sigue siendo desconocido (5). Es importante destacar que una proporción significativa de las muertes se considera susceptible de intervenciones preventivas de salud, como el control de los FRC (16).
En este estudio, 75% de los pacientes evaluados presentaron al menos un FRC, el grupo de individuos con dos FRC fue el más frecuente. Por su parte, la dislipidemia fue el más frecuente y dentro de esta la presencia de C-HDL bajo fue el más común, al igual que el estudio chileno recientemente publicado en niños y adolescentes con SD (5). Igualmente, niveles de C-HDL bajo y cifras de triglicéridos altas, colesterol total y C-LDL se han descrito en otros estudios, lo que indica un perfil lipídico desfavorable en esta entidad (12,35). Ante esto, un diagnóstico asertivo de dislipidemia puede permitir un tratamiento precoz, que consiste principalmente en cambios del estilo de vida, que incluye modificaciones en los hábitos dietéticos y de ejercicio. De no evidenciarse mejoría en la respuesta en esta primera etapa, y si los niveles de alteración lo ameritan, debe considerarse el inicio de terapia farmacológica (5).
Por otra parte, son pocos los estudios que caracterizan el perfil lipídico de la población con SD, en su mayoría estudios caso-control con muestras pequeñas y varios de ellos en población adulta. No obstante, los estudios en población pediátrica muestran una mayor incidencia de dislipidemia en los niños con SD en comparación con la población pediátrica general con resultados variables, siendo los más constantes la elevación de las cifras de triglicéridos y disminución en los de C-HDL (5,12), condición que puede ser independiente del estado nutricional (5). No está claro si tienen un perfil lipídico particularmente aterogénico antes de desarrollar obesidad y diabetes (12).
La dislipidemia fue mayor en el sexo masculino y, por otra parte, en este estudio se observò una frecuencia significativamente mayor de valores de C-HDL bajo en el grupo del área urbana. Se puede inferir que el estilo de vida, los hábitos alimentarios, así como la forma de preparación de alimentos pueden influir en el área urbana.
En la población mayor de dos años estudiada en esta investigación, el sedentarismo estuvo presente en 45,2%, en general los pacientes con SD presentan mayor sedentarismo, ya que son menos activos que sus pares sin la entidad. Sin embargo, el porcentaje de sedentarismo de 49,3% fue mayor, en población de niños y adolescentes de la región sin la entidad genética (16). La elevada frecuencia de sedentarismo es preocupante, ya que, la actividad física podría mejorar los FRC (6). Es notable además la mayor frecuencia de Pre-HTA/HTA en este grupo de niños con SD (24,1%) en comparación con aquellos sin SD (8,8%) (16), se sugiere que el SD es una condición “protectora” de HTA, tener esta frecuenta es alarmante, ya que este factor de riesgo claramente incrementa el riesgo de eventos clínicos cardiovasculares en la edad adulta (6).
Por otra parte, en niños y adolescentes sin SD de la ciudad de Mérida, Venezuela el sobrepeso y la obesidad se asociaron fuertemente a la presencia de FRC(16), sin embargo, en este estudio no se encontró este hallazgo, de hecho, apenas el 5,6% de estos niños mostraron sobrepeso-obesidad. No obstante, se evidenciaron correlaciones significativas de la PAS, PAD y niveles de C-HDL bajo con indicadores de composición corporal que reflejan adiposidad y distribución de esta.
Al respecto, la dislipidemia, los valores de C-HDL bajo y la pre-HTA/HTA mostraron relación significativa con la circunferencia de cintura, el PSe, PTr, y los IS e ICO, la evidencia actual sugiere que estos pueden iniciarse a edades tempranas, lo que puede predecir en el futuro la aparición de diabetes mellitus y enfermedad cardiovascular (36).
El IC y el pliegue suprailíaco presentaron relación significativa, aunque menor que los anteriormente descritos. La importancia de estos hallazgos es que con el número de individuos estudiados se encontró relación significativa entre la mayoría de los indicadores de composición corporal y algunos FRC.
Los resultados sugieren que la distribución de grasa abdominal estimada a través de la circunferencia de cintura, ICO, IS, e IC puede ayudar a la identificación a temprana edad de los FRC, sobre los cuales se puede actuar con carácter preventivo.
Se sugiere que es necesario validar esta información con determinaciones de composición corporal propias, en vista que en nuestro país no se cuentan con consensos de criterios de evaluación nutricional para menores de 18 años. Lo ideal sería tener puntos de corte nacionales tanto para indicadores de composición corporal como para los distintos FRC en individuos con SD y así poder hacer diagnósticos más certeros. Igualmente, no existe un consenso en valores de referencia de estudios bioquímicos. En caso de tener estas herramientas sería posible mejorar los diagnósticos clínicos antropométricos y así mejorar las intervenciones clínicas y nutricionales de estos niños.
El grupo de niños y adolescentes con SD presentó una prevalencia de FRC mayor que la reportada en la población sin esta entidad genética, y los indicadores de adiposidad se correlacionaron con los factores de riesgo cardiometabólico. Estos indicadores de composición corporal son una herramienta sencilla y de fácil aplicación que refleja la adiposidad central y a su vez están fuertemente relacionados con los FRC, se deben detectar a temprana edad y así hacer el abordaje nutricional oportuno para disminuir la prevalencia de enfermedades crónicas degenerativas en la edad adulta. Es necesario lograr un consenso nacional para el diagnóstico del estado nutricional en niños y adolescentes con SD, así como enfatizar el uso de referencias de la propia población en percentiles por edad y sexo como punto de corte en el cálculo de los componentes de los FRC. Igualmente, se sugiere la realización de nuevos estudios con métodos de referencia de valoración de la masa grasa, para elaborar puntos de corte específicos para el cálculo del área grasa con pliegues cutáneos en población pediátrica con SD.
Recibido: 04-09-2019
Aceptado: 03-12-2019