La modificación oxidativa de las lipoproteínas plasmáticas es un paso importante en la formación de la placa de ateroma. Por otra parte, existen evidencias de que la aterogénesis comienza durante etapas tempranas de la vida, por lo que es de interés evaluar la susceptibilidad al estrés oxidativo de las lipoproteínas del plasma en la infancia. Se estudiaron 24 niños escolares aparentemente sanos (7 a 9 años de edad) que asistieron a unidades educativas de los Estados. Carabobo y Lara (Venezuela) durante el periodo escolar 2003-2004. La VLDL y LDL del plasma se sometieron a oxidación in vitro con cobre y se midió la concentración de las sustancias reactivas al ácido tiobarbitúrico (TBARS) luego de tres horas de incubación. La susceptibilidad a la oxidación se relacionó a variables antropométricas (peso-talla, talla-edad, área grasa), hematológicas (hemoglobina y hematocrito) y bioquímicas (concentración plasmática de colesterol total, LDL-c, HDL-c, triglicéridos y ferritina). Bajo las condiciones de nuestro experimento, 50% de los niños estudiados presentó oxidación de la LDL, 62,5% oxidación de la VLDL y 33% oxidación de ambas lipoproteínas. La susceptibilidad a la oxidación no se asoció a las variables antropométricas y hematológicas estudiadas. La oxidación de la LDL se correlacionó negativamente con la concentración de ferritina plasmática (r= -0,61, p<0,05). Esto último contrasta con el rol del hierro como agente prooxidante. Nosotros proponemos que posiblemente los niños ferropénicos presentan otros déficit nutricionales que condicionan una baja reserva antioxidante, probablemente debido al consumo de dietas bajas en antioxidantes y/o cofactores de enzimas antioxidantes.
Palabras clave: oxidación de lipoproteínas, LDL, VLDL, ferritina, aterogénesis, nutrición en la infancia, niños.
The oxidative modification of plasma lipoproteins is an important step in the formation of the atherosclerotic plaque. On the other hand, there are evidences that atherogenesis begins during early stages of life, therefore it is of interest to evaluate the susceptibility to oxidative stress of plasma lipoproteins in childhood. Twenty-four children apparently healthy (7 to 9 years of age) who attended to elementary schools in Carabobo and Lara States (Venezuela) during the school period 2003-2004 were studied. Plasma VLDL and LDL were submitted to oxidation in vitro with copper and concentrations of the resulting thiobarbituric acid reacting substances (TBARS) were determinated after three hours of incubation. The susceptibility to oxidation was related to anthropometrics (weigh-height, height-age, fat area), haematologics (hemoglobin and hematocrit) and biochemicals variables (plasmatic concentration of total cholesterol, LDL-c, HDL-c, triglycerides and ferritin). Under the conditions of our experiment, 50% of the studied children displayed oxidation of LDL, 62.5% oxidation of VLDL and 33% oxidation of both lipoproteins. The susceptibility to oxidation was not associated to anthropometrics and haematologic variables. The oxidation of LDL was negatively correlated with concentration of plasmatic ferritin (r = -0.61, p<0.05). This last one contrasts with the role of iron as a prooxidant agent. We propose that possibly ferropenics children present other nutritional deficits that condition a low antioxidant reserve, probably due to the intake of diets low in antioxidants and/or cofactors of antioxidant enzymes.
Key words: lipoprotein oxidation, VLDL, LDL, ferritin, atherogenesis, childhood nutrition, children
Actualmente se reconoce que la modificación oxidativa de la lipoproteína de baja densidad (LDL) constituye un paso clave en la formación de la placa ateromatosa. Las LDL modificadas son captadas de forma incontrolada por los receptores scavenger encontrados en los macrófagos y células musculares lisas, lo cual conduce a la formación de células espumosas (1). Por otra parte, hoy también se le concede importancia a las modificaciones oxidativas que pueden sufrir otras lipoproteínas, como la lipoproteína de muy baja densidad (VLDL). Sin embargo, aún existe mucho que aclarar en este aspecto. Se sabe que la VLDL induce la formación de células espumosas en su estado nativo o en su forma oxidada (2) a diferencia de la LDL que sólo es captada en su forma oxidada. La captación de la VLDL oxidada ocurre directamente mediada por receptores scavenger, así la oxidación de dicha lipoproteína incrementaría la captación de lípidos por parte de las células (3). La VLDL se ha encontrado en lesiones ateroscleróticas (4,5) y se ha propuesto que en situaciones que impliquen aumento de la concentración de triglicéridos es probable que la VLDL contribuya significativamente al riesgo cardiovascular (3).
El estudio Pathological Determinants of Atherosclerosis in Youth (PDAY) ha confirmado que la ateroesclerosis se inicia en la infancia (6). Iughetti y col. (7) han reportado en niños sanos, normocolesterolémicos y libres de riesgo cardiovascular, títulos incrementados de anticuerpos contra LDL oxidada, lo cual se correlaciona con la susceptibilidad de oxidación in vitro de la LDL aislada del plasma. En el caso de la susceptibilidad oxidativa de la VLDL, según la revisión bibliográfica realizada, no existen estudios que hayan explorado este aspecto en niños.
Con el propósito de ampliar el conocimiento sobre la aterogénesis en niños es necesario investigar las posibles asociaciones entre los procesos oxidativos de las lipoproteínas y diferentes variables bioquímicas y antropométricas. Varios estudios han revelado una elevada susceptibilidad a la oxidación de la LDL en adultos (8, 9) y en niños obesos (10, 11). De los aspectos bioquímicos que se pueden relacionar con la susceptibilidad a la oxidación de la LDL y VLDL son relevantes los asociados a las concentraciones plasmáticas de colesterol en el caso de la LDL y de triglicéridos en el caso de la VLDL.
Adicionalmente, es interesante considerar aspectos nutricionales relacionados con el hierro, ya que se ha planteado que los depósitos de este micronutriente, medidos a través de las concentraciones séricas de ferritina, podrían estar positivamente asociados con la oxidación in vivo de la LDL debido a la acción prooxidante del hierro. En niños con b-talasemia Livrea y col. (12) hallaron que la ferritina sérica estuvo correlacionada positivamente con la generación de dienos conjugados durante la oxidación de la LDL. Sin embargo, para nuestro conocimiento no existen trabajos que relacionen en niños sanos la susceptibilidad a la oxidación de la LDL y VLDL a la ferritina plasmática.
El objetivo de presente estudio fue evaluar la susceptibilidad a la oxidación de las lipoproteínas plasmáticas de baja y muy baja densidad en un grupo de niños aparentemente sanos y su asociación con parámetros antropométricos, hematológicos y bioquímicos de interés.
La muestra estudiada estuvo integrada por 24 niños aparentemente sanos, con edades comprendidas entre los 7 y 9 años de edad, que participaron en el Estudio de Condiciones de Vida de principales ciudades del país llevado a cabo por Fundacredesa (Fundación Centro de Estudios sobre crecimiento y desarrollo de la población venezolana, Ministerio de Salud y Desarrollo Social de Venezuela) entre marzo y junio del año 2004.
Por venipuntura de la vena del pliegue del codo se extrajeron 8 mL de sangre, los cuales fueron distribuidos en dos tubos VacutainerÒ (Becton Dickinson, USA) con anticoagulante EDTA. Una de las alícuotas sirvió para determinar hemoglobina y hematocrito. A partir de la segunda alícuota se separó el plasma mediante centrifugación por 15 min., el cual se empleo para determinar colesterol total, triglicéridos, HDL-colesterol, ferritina y susceptibilidad a la oxidación de las LDL y VLDL. Las muestras que se analizaron en este estudio se seleccionaron por azar al ingresar al laboratorio considerando que presentaran un volumen no menor de 8 mL de sangre con el objeto de asegurar la obtención de suficiente plasma para realizar la separación de las lipoproteínas.
La determinación de la concentración de hemoglobina se realizó por el método de la cianometahemoglobina, mientras que el valor hematocrito fue determinado a través del método de microhematocrito (13). La ferritina en plasma se midió a través de análisis inmunoenzimático (ELISA) empleando anticuerpos monoclonales contra ferritina. Los puntos de corte aplicados para hemoglobina, hematocrito y ferritina fueron los dictados por la OMS en el año 2001 (14).
Se cuantificó el colesterol total y triglicéridos empleando métodos enzimáticos-colorimétricos (Laboratorio CienVar, Laboratorio Vargas, Caracas, Venezuela). Se separó la lipoproteína de alta densidad del plasma mediante la técnica de precipitación con polianiones (15). El colesterol de la fracción HDL se determinó por el método enzimático referido. En los niños estudiados la concentración de triglicéridos fue inferior a 400 mg/dL, por lo que se calculó el valor del colesterol en la VLDL dividiendo el valor de triglicéridos por cinco. Se estimó LDL-c mediante la formula de Friedewald (16). Para el colesterol y los triglicéridos se emplearon las distribuciones percentilares según sexo y edad del Proyecto Venezuela (17) y se consideraron elevados cuando se encontraron por encima al percentil 90 y bajos cuando se ubicaron por debajo o igual al percentil 10. Para LDL-c y HDL-c se utilizaron los criterios del National Cholesterol Education Program's Expert Panel on Blood Cholesterol in Children and Adolescents (18). Se consideró elevada la concentración de VLDL-c cuando ésta se encontró por encima del percentil 95 del Estudio de Bogalusa para niños de 5-14 años de raza blanca según género (19).
Para la determinación del grado de oxidación de la LDL y VLDL se separaron las lipoproteínas mediante la técnica de ajuste de densidad y ultracentrifugaciones sucesivas. Para ello se llevo 1,5 a 2 mL de plasma a 8 mL de volumen total con solución salina ajustada a d=1,006 g/mL y se ultracentrifugó por 24 horas a 105000 g con una ultracentrífuga marca Beckman (L5-65, USA). Del sobrenadante se tomó 1mL, lo cual correspondió a la VLDL, y se descartó el volumen de líquido restante hasta la marca que en el tubo indicaba el volumen inicial de plasma empleado. Se colocó 1-2 mL de infranadante homogenizado en otro tubo de ultracentrífuga, se añadió bromuro de potasio (KBr) sólido en proporción de 0,080056 g/mL de plasma, se agitó suavemente, y se completó el volumen total a 8 mL con solución de KBr ajustado a d=1,063 g/mL llevándose a ultracentrífuga en las mismas condiciones. Se retiro 1,5 mL del sobrenadante obtenido, lo cual correspondió a la LDL. Una vez separadas las lipoproteínas se eliminó el KBr de las mismas mediante cromatografía de exclusión en columna de 5 cm de altura empacada con Sephadex G-25 M y equilibrada con disolución buffer (trizma base 10mM-NaCl 0,14 M, pH=7.2). Posteriormente se midió el contenido de proteínas de las lipoproteínas por el método de Lowry modificado por Shacterle y Pollack (20) y se realizó por duplicado la prueba de oxidación in vitro de las lipoproteínas estudiadas (21) adicionando un volumen de sulfato de cobre (500 mM) hasta lograr una concentración final de CuSO4 de 17,5 mM para el caso de la oxidación de la VLDL (22) y de 7 mM para la LDL (23).
Los tubos se incubaron con agitación constante a 37°C por 3 horas. Transcurrido el tiempo experimental se añadió 10 ml de una disolución del antioxidante 3,5-di-tert-butil-4-hidroxitolueno (BHT) 10 mM en etanol. El grado de oxidación se midió mediante método propuesto por Kosugi y col. (24), el cual se fundamenta en la reacción química entre el ácido tiobarbitúrico y los productos formados durante la peroxidación lipídica. El grado de oxidación se expresó como nmol TBARS/mg proteína y se obtuvo a partir de una curva de calibración preparada con 1, 1, 3,3 tetrametoxipropano como patrón. Las muestras no oxidables por nuestro procedimiento fueron reanalizadas en cuatro oportunidades y en lotes distintos de análisis, encontrándose el mismo resultado en todos los casos.
Se midió el peso corporal, la talla, el pliegue tricipital y la circunferencia media del brazo izquierdo de cada niño, lo cual estuvo a cargo del personal entrenado de Fundacredesa. A partir de dichas medidas se obtuvieron los indicadores peso-talla, talla-edad e índice de masa corporal (peso/talla2). Se calculó el área grasa a partir de las medidas de pliegue tricipital y circunferencia media del brazo izquierdo. Para los indicadores peso-talla y talla-edad se emplearon las distribuciones percentilares según sexo y edad del Proyecto Venezuela (17) y los puntos de corte dictados por la OMS (25).
Para el análisis estadístico descriptivo se determino media, desviación estándar y frecuencias absolutas y relativas. Para comparar grupos se empleó la Prueba de t-student y el análisis de correlación entre variables se estableció a través del coeficiente de Pearson. Se verificó la distribución normal de las variables estudiadas mediante la prueba de Kolmogorov-Smirnov, la cual compara la función de distribución acumulada observada de las variables con una distribución teórica que se especifica, que en este caso fue la normal.
La edad promedio de la muestra estudiada fue de 8,5±1,1 años y en cuanto a la distribución por género, 45,8% de los niños eran de género femenino y 54,2% del género masculino. La distribución de acuerdo al estrato socioeconómico, obtenido a través el Método de Graffar-modificado para Venezuela (26), mostró que 12,5% de los niños pertenecieron al estrato III, 66,7% al estrato IV y un 20,8% al estrato V. Los niños procedieron del Edo. Carabobo (70,8%) y del Edo. Lara (24,2%). El 14% (n=3) de los niños presentaron déficit de peso (peso-talla £ percentil 10) y un porcentaje igual sobrepeso (peso-talla > percentil 90). Ninguno de los niños estudiados resulto obeso (peso-talla > percentil 97). Así mismo el 14% mostró talla baja para su edad (talla-edad £ percentil 3).
El 50% de los niños presentaron déficit de hierro, definido como concentraciones de ferritina en plasma iguales o menores a 15 ng/mL. El 18% de los niños fueron anémicos (hemoglobina < 11,5 g/dL). En relación a la distribución de la concentración de colesterol total, 21% de los niños presentaron concentraciones menores o iguales al percentil 10 mientras que sólo 4% de ellos concentraciones superiores al percentil 90. Sólo un niño presentó concentración elevada de triglicéridos. El 4% de la muestra presentó cifras de LDL-c superiores o iguales a 130 mg/dL. El 62,5% de los niños mostró concentraciones de HDL-c inferiores a 40 mg/dL. Ninguno de los niños estudiados presentó concentraciones elevadas de VLDL-c.
La susceptibilidad a la oxidación de la LDL y VLDL mostró una amplia variabilidad entre los individuos evaluados. Se observaron dos grupos dentro de la muestra estudiada, un grupo de niños cuya LDL y/o VLDL no fue susceptible de oxidación y otro grupo cuyas lipoproteínas fueron susceptible a oxidarse, así el 50% de los niños presentaron oxidación de la LDL, 62,5% de la VLDL, y 33,3% en ambas lipoproteínas. El mayor grado de oxidación observado en LDL fue de 18,55 nmol TBARS/mg proteína mientras que en VLDL fue de 26,36 nmol TBARS/mg proteína. No se encontró correlación entre el grado de oxidación de la LDL y el de la VLDL. En las tablas 1 y 2 se presentan las medias±DE de las variables determinadas en el grupo total de niños estudiados y según el grado de oxidación de la LDL y VLDL del plasma. No se observaron diferencias estadísticamente significativas en las variables estudiadas entre los niños que presentaron susceptibilidad a la oxidación de las LDL y/o VLDL y aquellos que no mostraron la misma. Sin embargo, los niños cuyas LDL fueron susceptibles a oxidarse tendieron a presentar más área grasa, concentraciones mayores de colesterol total, triglicéridos y LDL-c y también cifras menores de ferritina. De igual manera, los niños con susceptibilidad a la oxidación de la VLDL tendieron a mostrar más área grasa y concentraciones mayores de colesterol total, triglicéridos y LDL-c.
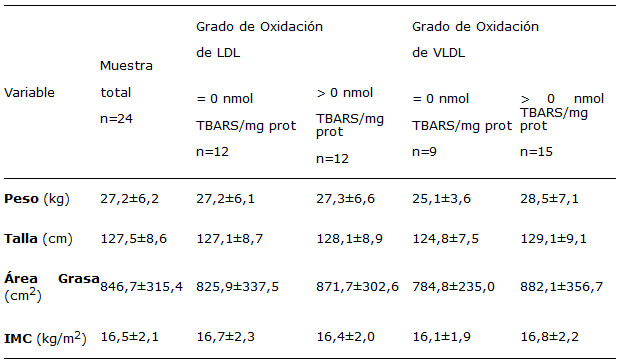
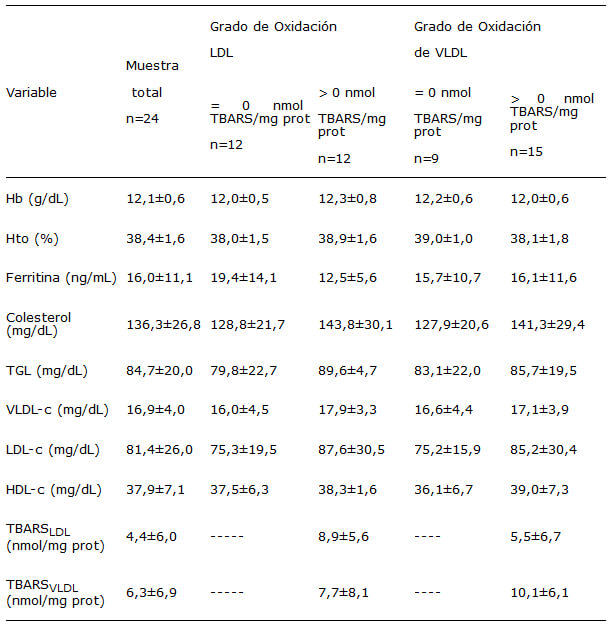
La susceptibilidad a la oxidación de la LDL y de la VLDL no se correlaciono significativamente con las variables antropométricas y hematológicas medidas o las concentraciones de colesterol total, LDL-c, HDL-c y triglicéridos. Entre los niños que presentaron oxidación en LDL, se encontró que el grado de oxidación de la LDL fue mayor en los niños con deficiencia de hierro (p< 0,05) observándose una correlación inversa entre el grado de oxidación de la LDL y la concentración de ferritina plasmática (r= -0,612; p<0,05). En el grupo de niños que presentaron oxidación en VLDL el grado de oxidación de la VLDL presentó una tendencia a aumentar con la concentración de triglicéridos en el plasma (r= 0,456; p=0,088) aunque esto no fue estadísticamente significativo.
Como anteriormente se ha señalado existen pocos estudios que hayan explorado la susceptibilidad de oxidación de las lipoproteínas en los niños (7, 10,11). Entre los individuos estudiados existió una gran variabilidad en torno a la susceptibilidad a la oxidación de la LDL y VLDL del plasma, encontrándose un grupo que presentó oxidación y otro en el que no se produjo la misma, indicando que existen un grupo de niños cuyas lipoproteínas son más resistentes a sufrir cambios oxidativos. Tal variabilidad pudiera explicarse en el carácter multifactorial que rodea al proceso oxidativo de las lipoproteínas. Uno de los factores de mayor importancia es la ingesta dietética de ácidos grasos y antioxidantes, lo cual determina la composición de la lipoproteína y por ende su susceptibilidad a la oxidación (27).
El hallazgo sugiere posibles diferencias dietarias que impliquen alto consumo de ácidos grasos poliinsaturados presentes en aceites de origen vegetal e ingesta baja de alimentos fuentes de antioxidantes en los niños cuyas lipoproteínas fueron susceptibles a oxidación. También podría estar relacionado con la historia familiar ya que se ha observado un aumento de la susceptibilidad a la oxidación en la LDL en niños con alto riesgo familiar de enfermedad cardiovascular prematura (28).
En nuestro estudio no fue posible determinar la fase de retardo o latencia de la cinética de oxidación de las lipoproteínas, parámetro que representa la resistencia de la lipoproteína a la oxidación y que depende de su composición en antioxidantes y lípidos (27). Sin embargo, existió una observación indirecta de la resistencia de la oxidación de la VLDL del plasma de los niños estudiados. En este sentido, se probó la oxidación de la VLDL con dos concentraciones finales de cobre, una de 7mM (igual a la utilizada para la LDL) y otra de 17,5 mM empleada por McEneny y col. (22). Con la primera concentración no se observó oxidación de la VLDL en ninguna de las muestras, mientras que con la segunda concentración si fue observada, de tal manera que se requirió de mayor cantidad de iones metálicos para inducir la oxidación, lo que nos indica de forma indirecta de la resistencia que presentó la lipoproteína a oxidarse. Las VLDL son más resistentes a la oxidación debido al tamaño de sus partículas.
A medida que las lipoproteínas disminuyen su tamaño crece su susceptibilidad a la oxidación, esto se atribuye al incremento de la relación superficie-área/volumen lo cual facilita la exposición de los ácidos grasos en la superficie de la partícula y su interacción con los radicales libres (3). Así mismo se ha encontrado que las partículas de VLDL grandes contienen más moléculas de antioxidantes, tales como a-tocoferol, por partícula de lipoproteína (29, 30).
Debido a la baja incidencia de desnutrición y sobrepeso en la muestra estudiada no fue posible comparar la susceptibilidad de oxidación de la LDL y VLDL según el indicador peso-talla. De la misma forma tampoco fue posible conocer si la susceptibilidad a la oxidación de la VLDL y LDL en los niños obesos se comporto diferente a la de los niños con sobrepeso. Como ya se ha comentado tanto en adultos como en niños obesos se ha observado un aumento de la peroxidación de las lipoproteínas del plasma.
Los niños en los cuales se observó oxidación de la LDL o de la VLDL tendieron a presentar un área grasa corporal superior a la de los niños en quienes no se observó oxidación, sin embargo, esta diferencia no fue significativa. Posiblemente no se hallaron diferencias estadísticamente significativas en razón de que la muestra estudiada fue pequeña y sólo existieron tres casos de sobrepeso según el indicador peso-talla. De igual manera la susceptibilidad a la oxidación no difirió en relación a las concentraciones de colesterol o LDL-c. Esto último apoya lo que se ha expuesto en los últimos años en cuanto a que la modificación oxidativa de las lipoproteínas debe considerarse un factor adicional al incremento de los lípidos plasmáticos.
Un hallazgo importante de este trabajo fue que entre los niños que presentaron oxidación de la LDL, la oxidación de dicha lipoproteína fue significativamente superior en los niños deficientes de hierro en comparación con los que presentaron reservas de hierro adecuadas. En vista de que el hierro es un catión prooxidante (31), se esperaría una relación positiva entre oxidación y depósitos corporales del hierro. Sin embargo, el resultado puede explicarse en términos de que posiblemente la ferropenia en los niños estudiados puede estar acompañada de un déficit conjunto de nutrientes que actúan como antioxidantes directos (vitamina C y E, carotenoides) o forman parte de enzimas antioxidantes como el zinc en la superóxido dismutasa y el selenio en la glutation peroxidasa (32). Adicionalmente aunque el hierro y el cobre son cationes que tienen propiedades prooxidantes también constituyen micronutrientes que intervienen en el sistema de defensa antioxidante al formar parte de la catalasa en el caso del hierro y al integrar la superóxido dismutasa en el caso del cobre (32).
La susceptibilidad a la oxidación de la VLDL tendió a ser superior al incrementarse los triglicéridos. Este hallazgo concuerda con lo reportado por Whitman y col. (33) en sujetos con aumento de la VLDL. Para nuestro conocimiento no existen estudios en niños sobre la susceptibilidad de oxidación de la lipoproteína de muy baja densidad. McEneny y col. han observado aumento de la oxidación de la VLDL en individuos adultos que sufren condiciones que cursan con hipertriglicéridemia y elevada incidencia de enfermedad cardiovascular como son la enfermedad renal (22) y la diabetes mellitus (34).
En conclusión, la susceptibilidad de oxidación de LDL y VLDL en los niños no se asoció a las variables antropométricas analizadas, a las cifras de hemoglobina y hematocrito o a las variables de perfil lipídico medidas. Sin embargo, la susceptibilidad de oxidación de LDL se asoció inversamente con la concentración de ferritina en plasma, lo cual puede ser explicado por un déficit conjunto de hierro y de nutrientes antioxidantes. Considerando esto último el hambre oculta en los niños condicionaría un aumento de la oxidación de las lipoproteínas y con ello riesgo cardiovascular.
A fin de aclarar la asociación inversa observada entre la oxidación lipídica y la ferritina en plasma, en futuros trabajos debe establecerse la relación entre la ingesta dietética de los niños de los principales nutrientes con funciones antioxidantes y la susceptibilidad de oxidación de las lipoproteínas. De igual manera deben realizarse estudios adicionales que ayuden a explicar la variabilidad de la susceptibilidad de oxidación de las lipoproteínas plasmáticas entre los niños de edad escolar.
A todos los niños que formaron parte del estudio. A todo el personal de Fundacredesa y de la Sección de Lipidología del Instituto de Medicina Experimental que de una u otra forma colaboraron en la recolección y procesamiento de las muestras analizadas. Al personal del Laboratorio de Fisiopatología del Centro de Medicina Experimental del Instituto Venezolano de Investigaciones Científicas que participo en la determinación de la ferritina. Al Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela por el financiamiento concedido a esta investigación.