El consumo de calcio ayuda a disminuir el riesgo de padecer osteoporosis, hipertensión, cáncer, litiasis renal y obesidad. Estudios han demostrado que la suplementación con calcio aumenta o previene la pérdida de masa ósea, lo cual es vital para la prevención de la osteoporosis. Estudios también han demostrado el impacto positivo del calcio en la regulación de la presión arterial y en la prevención del cáncer de colon, mama y ovario, posiblemente a través de su participación en la división celular. Una dieta alta en calcio ayuda a prevenir los cálculos renales al disminuir la absorción de oxalato y recientemente, se ha sugerido que también puede ayudar en el control del peso, disminuyendo la lipogénesis y aumentado la lipólisis. El efecto protector del calcio es notorio en los niveles recomendados de ingesta de calcio para la mayor parte de la población, es decir, entre 1000 y 1300 mg diarios de calcio.
Palabras clave: Calcio, osteoporosis, hipertensión, cáncer, cálculos renales, obesidad.
Intake of dietary calcium decreases the risk of osteoporosis, hypertension, cancer, kidney stones, and obesity. Studies have shown that calcium supplementation increases bone mass and prevents its loss, which is crucial in the prevention of osteoporosis. Likewise, studies have confirmed the impact of calcium in the regulation of blood pressure and in the prevention of colon, mammary and ovary cancer, possibly through its action on cellular division. A diet rich in calcium can also help against kidney stones by reducing oxalate absorption, and recently, it has been suggested that a diet rich in calcium can help in weight management, reducing lipogenesis and increasing lipolysis. The protective effects of calcium are seen within the levels actually recommended for the population, which are between 1000 and 1300 mg per day of dietary calcium.
Key words: Calcium, osteoporosis, hypertension, cancer, kidney stones, obesity.
El calcio es un nutriente que se encuentra involucrado en la prevención de enfermedades crónicas, como la osteoporosis, la hipertensión arterial, el cáncer de colon, de mama y de ovario, los cálculos renales y la obesidad. La asociación entre el calcio y estas enfermedades tiene su explicación en la variedad de funciones que este nutriente cumple en el organismo. El calcio es el mineral más abundante en el cuerpo humano donde forma parte de los dientes y los huesos, donde representa hasta el 40% del contenido mineral. El calcio es también considerado un segundo mensajero, debido a que actúa tanto como un transmisor de señales desde fuera de la célula hacia dentro, como un activador de proteínas involucradas en este proceso. De esta manera, el calcio se encuentra involucrado en la secreción de hormonas, en la mediación de la dilatación y de la contracción muscular y vascular, así como en la conducción neural.
A continuación se presenta una revisión de la evidencia del papel del calcio en patologías crónicas como la osteoporosis, la hipertensión arterial, el cáncer, la litiasis renal, y la obesidad.
El 99% del calcio se encuentra en los huesos y sólo 1% en la sangre, músculo, y otros tejidos. Sin embargo, esta pequeña fracción tiene prioridad y el calcio contenido en los huesos constituye un gran reservorio del cual puede ser extraído en cualquier momento para mantener constante el nivel sérico de calcio si la ingesta dietética es baja. Si la ingesta de calcio es persistentemente baja, los huesos se van haciendo cada vez más frágiles, lo cual puede conducir a la osteoporosis.
La osteoporosis es una enfermedad crónica y multifactorial que puede progresar en forma silente por décadas hasta que ocurra una fractura. Se caracteriza por una baja densidad ósea y por un deterioro de la microarquitectura ósea (1), lo cual produce una mayor vulnerabilidad de sufrir fracturas, principalmente en la muñeca, cadera y espina dorsal (2,3).
En el mundo más de 200 millones de personas tienen osteoporosis, y según proyecciones, el número de fracturas de cadera al año aumentará de 1.66 millones en 1990 a 6.26 millones en el 2050 (4). En Venezuela, no se conoce bien la magnitud del problema. Según un reporte en 1980, la incidencia de fracturas de cadera en >45 años fue de 348 y 834 (5), y en 1988 la incidencia en >80 años fue de 193 y 381 (6), por cada 100.000 habitantes, en hombres y mujeres, respectivamente (5).
La osteoporosis es una enfermedad juvenil, ya que es en la adolescencia cuando se adquiere la mayor parte de la masa ósea, lo cual determinará si la persona tendrá riesgo de sufrir fracturas en los próximos años. Así, a los 17 años de edad la adolescente femenina ha adquirido el 90% de su masa ósea, a los 19.8 años el 95% y a los 22.1 años el 99% de su masa ósea (7). Es decir, que después de los 22 años la mujer básicamente ya tiene formada su masa ósea. Aunque el proceso de la adquisición de la masa ósea esta determinado en un 60-80% por la genética del individuo, existen factores modificables que afectan este proceso, como ingesta de calcio, actividad física y estilo de vida, dentro de los cuales, la ingesta de calcio es el que tiene mayor efecto (8). Si en la adolescencia el individuo no consume una ingesta adecuada de calcio, no llegará al pico máximo de masa ósea y el individuo entrará en la etapa adulta con una densidad ósea inferior a su potencial genético (línea punteada, Figura 1). Cuando comience el período de rápida pérdida de la masa ósea, lo que se corresponde con la menopausia, este individuo podría llegar a presentar fracturas. El desarrollo de la masa ósea hasta el potencial del pico máximo protege contra la osteoporosis, ya que hay una relación inversa entre la densidad mineral ósea y la incidencia de fracturas (9,10).
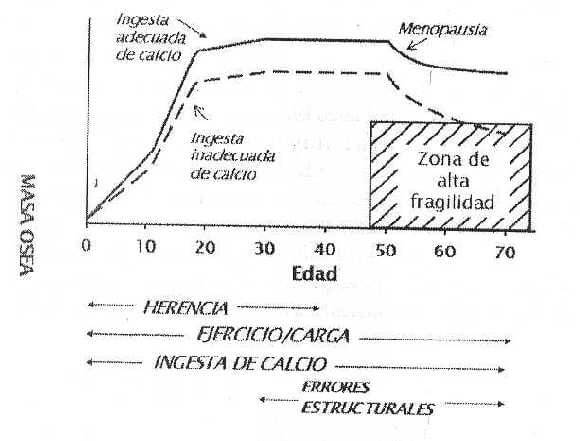
Estudios en adolescentes y niños (11-14) y en adultos (15-18) han demostrado que la suplementación con calcio aumenta la masa ósea. La suplementación en gemelas idénticas (6-14 años) con 1612 mg/d de calcio aumentó significativamente la densidad ósea comparado al grupo con un consumo de 908 mg/d de calcio (12). Estudios en niñas americanas y en niños chinos demostró que la suplementación con calcio por 18 meses resultó en un incremento adicional significativo en la densidad y contenido ósea total sobre el grupo control (11,13). En niñas adolescentes se observó un incremento de 35 g más en el contenido mineral óseo con la suplementación de productos lácteos durante un año comparado con el grupo control (14). Estos efectos se mantienen sólo si la alta ingesta de calcio es constante, y no como una intervención corta, ya que después de un año de la intervención, desaparecieron las diferencias en densidad ósea (19). Se ha observado que si el consumo diario de calcio se mantiene alto durante toda la infancia y la adolescencia, esto resulta en alta densidad ósea del radio en mujeres post-menopáusicas.
Estudios transversales y de intervención en adultos reportan una relación positiva entre la ingesta de calcio y la masa ósea. Un meta-análisis de 33 estudios evidenció una correlación significativa entre la ingesta de calcio y la densidad ósea (21). Se concluyó que la ingesta de 1 g/d de calcio puede prevenir la pérdida de 1% de hueso/año en la mayoría de las regiones del cuerpo. En los primeros años de la post-menopausia, la masa ósea no responde tanto a la suplementación con calcio, ya que es una etapa de rápida reabsorción ósea, sin embargo, si favorece a aquellas mujeres con más de 5 años posmenopáusicas (22). En ancianos también se ha observado que la intervención con calcio favorece la reducción del índice de fracturas (18).
La presión arterial alta es un problema de salud pública que afecta el 20%-23% de los adultos en Venezuela (23). Los niveles de presión arterial predicen la mortalidad y morbilidad de las enfermedades cardiovasculares (ECV), por lo que, cualquier factor que disminuya la presión arterial es importante a escala poblacional.
Después de 20 años de controversia la evidencia confirma el impacto positivo del calcio y los alimentos ricos en calcio en la regulación de la presión arterial, a través de 2 líneas de investigación:
1. Estudios epidemiológicos: El primer estudio que sistemáticamente investigó la relación entre el calcio y la presión arterial fue un análisis epidemiológico de la relación de 17 nutrientes con la presión arterial en norteamericanos (24). La baja ingesta de calcio fue el factor más consistente en individuos con hipertensión y se determinó que la alta ingesta de calcio estaba asociada con una baja presión arterial y un bajo riesgo absoluto de padecer hipertensión. Diversos meta-análisis han demostrado una disminución significativa en la presión arterial con una alta ingesta de calcio (25-28). Uno de estos análisis demostró que el calcio proveniente de los alimentos era más efectivo en la reducción de la presión arterial comparado con los suplementos (29). En niños también se ha visto este efecto protector, y se determinó que por cada aumento de 100 mg en la ingesta de calcio, se disminuía la presión sistólica en 2.27 mm Hg (30).
2.Estudios clínicos: Se han realizado numerosos estudios, algunos han utilizado suplementos de calcio como la fuente del nutriente y otros los alimentos. La suplementación de 1 g/d de calcio durante varias semanas (31) o días (32) resultó en una disminución significativa de la presión arterial. Recientemente se observó que aquellos con baja ingesta habitual de calcio se beneficiaban más de suplementación de calcio (33), aunque no todos los estudios muestran esto (34,35). Los resultados con el uso de la suplementación no son consistentes, posiblemente al uso de un solo nutriente aislado. Es por ésto que varios estudios han investigado el impacto de los alimentos ricos en calcio, los cuales también son buenas fuentes de magnesio y potasio, en la presión arterial. En hipertensos se observó una disminución del 9-8% en la presión arterial con el consumo de productos lácteos y jugo fortificado con calcio durante 6 semanas, comparado con el grupo control . El estudio "DASH" (37) investigó el efecto de 3 dietas en la presión arterial: 1) dieta alta en grasa saturada y baja en calcio (450 mg/d calcio); 2) dieta rica en frutas y vegetales pero baja en calcio (450 mg/d calcio); y 3) dieta rica en frutas y vegetales y en productos lácteos bajos en grasa saturada "dieta combinada" (1240 mg/d calcio). La dieta combinada redujo significativamente la presión arterial comparada con las otras dos dietas.
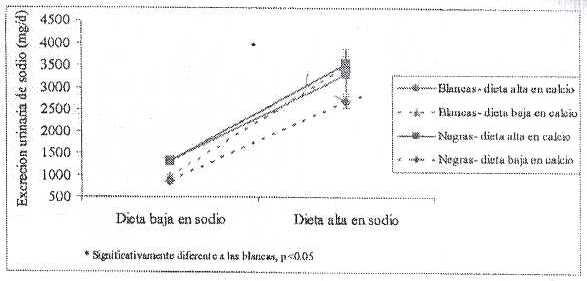
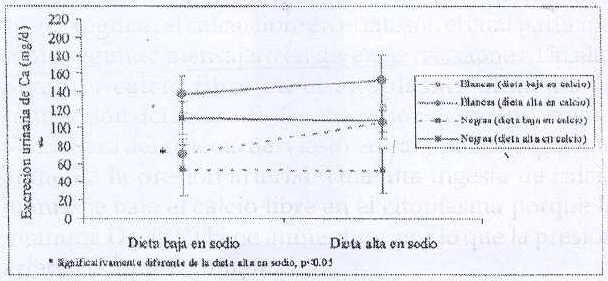
La interacción del calcio con otros nutrientes parece ser importante en el control de la presión arterial, como por ejemplo, la interacción sal-calcio. En hipertensos negros consumiendo una dieta baja/alta en calcio/sodio se observó un aumento en la presión arterial y en los niveles de la hormona paratiroidea (PTH), especialmente en los individuos de raza negra, lo cual fue abolido con la dieta alta en calcio (38). Esta diferencia racial también se encontró en niñas al consumir una dieta baja (800 mg/d) o alta (>1300 mg/d) en calcio y baja (1 g/d) o alta (3.86 g/d) en sodio durante 3 semanas (39). La excreción urinaria de sodio (Figura 2) y de calcio (Figura 3) fue significativamente menor en las niñas negras en la combinación alto sodio/bajo calcio, pero al añadir calcio a la dieta, las diferencias raciales desaparecieron. Estas diferencias raciales pueden ser resultado de alguna mutación en los canales de regulación de calcio y sodio a nivel renal, lo cual pueden estar presentes en otros grupos con alta incidencia de hipertensión (40-42).
El mecanismo por el cual el calcio y el sodio afectan la presión arterial es alterando sus sistemas regulatorios (43). En el caso del sodio, el sistema renina-aldosterona y en el caso del calcio, la vitamina D y la PTH. Estas hormonas a su vez regulan el calcio libre en el citosol, el cual participa como segundo mensajero en diversas reacciones. Un alto nivel de calcio libre en el citoplasma aumenta la contracción del músculo liso, secreción de catecolaminas y actividad del sistema nervioso central y por consiguiente aumenta la presión arterial. Una alta ingesta de calcio mantiene bajo el calcio libre en el citoplasma porque la vitamina D y la PTH no aumentan, por lo que la presión arterial tampoco aumenta.
El calcio también se encuentra involucrado en la prevención de la hipertensión inducida por el embarazo (HIE). En Guatemala se ha encontrado una baja incidencia de eclampsia y se explica por la alta ingesta en calcio (44). Sin embargo, en Colombia y en la India se ha observado una alta incidencia de eclampsia y en estas poblaciones se ha determinado que la ingesta de calcio es de 250-350 mg/d. En Ecuador se observó que la suplementación con 2 g/d de calcio redujo la presión arterial en adolescentes embarazadas (45). En un meta-análisis de 14 estudios aleatorios con suplementación de calcio en 2459 mujeres embarazadas se observó una disminución significativa en la presión arterial (26).
El cáncer es la tercera causa de muerte a nivel mundial. En el año 2000, alrededor de 7 millones de personas fallecieron por cáncer, lo cual representa el 12% de todas las muertes (46). Dentro de los distintos tipos de cáncer, el de colon se encuentra como la tercera causa de muerte y el de mama la quinta. En Venezuela en el año 2000 se presentaron 922 casos y 499 personas fallecieron de cáncer de colon, 442 casos y 282 personas fallecieron de cáncer de ovario, y 3400 casos y 1068 personas fallecieron de cáncer de mama (47).
Estudios epidemiológicos han demostrado que un alto consumo de calcio disminuye el riesgo de padecer cáncer de colon y su recurrencia. En estudios con más de 100 mil sujetos se determinó que la ingesta de 1200 mg/d de calcio estaba asociado a un menor riesgo e incidencia de cáncer de colon (48), tanto en hombres (49) como en mujeres (50). Estudios longitudinales con numerosos sujetos con o sin historia de cáncer de colon demuestran que el consumo de más de 2 porciones diarias de calcio protege contra el cáncer de colon recurrente (51), especialmente si se consumen productos lácteos bajos en grasa (52), lo cual resulta en un bajo riesgo relativo de cáncer de colon (53). Sin embargo, no todos los estudios han encontrado esta relación (54,55).
Estudios clínicos han encontrado una disminución de la actividad proliferativa de las células colónicas con el consumo de calcio (56,57). En sujetos con historia de adenoma colorectal, la suplementación con 1200 mg/d de calcio disminuyó el riesgo de recurrencia en 19% (58).
El mecanismo por el cual el calcio parece proteger contra el cáncer de colon radica en la participación del calcio en la división celular y en la regulación de la proliferación y diferenciación celular. Un bajo nivel de calcio ionizado intracelular contribuye a la proliferación celular mientras que las altas concentraciones disminuyen la proliferación de las células colónicas (59). Alternativamente, el calcio precipita los ácidos biliares y grasos en las heces (60), los cuales son potencialmente tóxicos, mientras que las sales insolubles de calcio son menos tóxicas para la mucosa colónica. La suplementación con calcio reduce la concentración de los ácidos biliares fecales (61). Sin embargo, no todos los estudios han demostrado estos beneficios (62-64).
En cuanto al cáncer de mama, se encontró que un alto consumo de productos lácteos estaba relacionado a un bajo riesgo relativo en mujeres jóvenes (65), pero no en mujeres post-menopaúsicas (66). En Uruguay se encontró que los productos lácteos bajos en grasa, especialmente los productos fermentados (yogurt), estaban relacionados a un menor riesgo de cáncer, mientras que los productos lácteos altos en grasa (chocolate y queso amarillo) a un mayor riesgo (67).
La ingesta de calcio también ha sido asociada con la prevención del cáncer ovárico. En mujeres se observó un bajo riesgo relativo con un alto consumo de productos lácteos bajos en grasa versus aquellas con bajo consumo (68), aunque otros no consiguieron este efecto (69).
Para observar el efecto protector del calcio en el cáncer no es necesario consumir niveles mas altos que los recomendados para la población en general, ya que estudios han demostrado que niveles mas altos de calcio (>1200 mg/d) no producen beneficios adicionales (48).
La incidencia de litiasis renal varía según la región, siendo baja en Asia (1%-5%), media en Europa (5%-9%) y Norte América (12%-13%) y alta en Medio Oriente (20%) (70). En Venezuela no se tienen datos nacionales sobre la incidencia de litiasis renal.
Los cálculos renales se forman cuando la orina se concentra y las sustancias que normalmente se encuentran en ella cristalizan, tal es el caso del oxalato y el calcio; por lo que la primera medida terapéutica ante una litiasis renal implicarían una reducción del consumo de calcio, sin embargo, existen evidencias que demuestran lo contrario. Un estudio con más de 45 mil hombres demostró que la alta ingesta de calcio disminuyó el riesgo de presentar cálculos renales en 34% (2), con un bajo riesgo relativo en aquellos con un alto consumo de calcio comparado con los que consumieron <850 mg/d de calcio. En mujeres también se observó que un alto consumo de calcio disminuyó el riesgo de cálculos renales, pero solo si el calcio provenía de los alimentos, ya que el uso de suplementos de calcio estuvo asociado positivamente al riesgo de cálculos renales, especialmente aquellas que consumieron el suplemento sin la comida (71). Los alimentos ricos en calcio (productos lácteos) pueden contener otras sustancias que ayuden a disminuir el riesgo.
Se ha sugerido que el mecanismo por el cual el calcio evita los cálculos renales es en la interferencia de la absorción intestinal del oxalato (72). Estudios clínicos demuestran que el calcio se une al oxalato a nivel intestinal, haciéndolo menos disponible para su absorción, lo que lleva a un menor contenido de oxalato en el organismo y por lo tanto a una menor excreción de oxalato en la orina (73,74). La alta concentración de oxalato en la orina es el que ocasiona el cálculo.
La obesidad es una epidemia a nivel mundial. Se estima que más de 1 billón de personas se encuentran en sobrepeso y al menos 300 millones de personas son obesos (75). Recientemente se ha relacionado la alta ingesta de calcio con una disminución en el peso corporal por su relación con el control del metabolismo de la grasa. El primer estudio en demostrar esta asociación fue un estudio epidemiológico en mujeres, donde aquellas con un alto consumo de calcio (>1300 mg/d calcio), presentaron un bajo riesgo relativo (0.16) de tener alta grasa corporal comparado con aquellas con una ingesta menor a 300 mg/d de calcio (76). En mujeres jóvenes se observó que un alto consumo de calcio con respecto al total de calorías disminuyó significativamente la grasa corporal (>3 kg) comparado con aquellas mujeres con una baja ingesta de calcio/kcal (77). En niños de 5 a 6 años también se observó una disminución significativa en la grasa corporal (2 kg) consumiendo 1200 mg/d versus aquellos que consumieron 500 mg/d (78) y en niños de 7 a 10 años se determinó que la baja ingesta en calcio resultó ser uno de los factores predictores de la obesidad (79).
Estudios clínicos también han demostrado este efecto. El consumo de 2 tazas de yogurt por día durante 12 meses resultó en una disminución total de 4.9 kg de grasa corporal al final de este período en obesos (76). Sujetos obesos asignados a una dieta exclusivamente a base de productos lácteos perdieron 7.4 kg, mientras que aquellos con una dieta mixta perdieron sólo 1.4 kg en 4 semanas (80). En un re-análisis de varios estudios en mujeres se determinó que por cada 1000 mg de diferencia en el consumo de calcio había 8 kg de diferencia en el peso corporal (81).
El efecto que tiene el calcio en el control de peso parece ser más efectivo con el consumo de productos lácteos comparado con el uso de suplementos de calcio, posiblemente debido a la presencia de otros compuestos bioactivos, aunque no hay estudios en humanos (82). En ratones obesos se observó una mayor disminución del peso corporal y masa grasa con una dieta mixta a base de productos lácteos versus la dieta con suplemento de calcio (83).
El mecanismo por el cual el calcio influye en el control de peso y en la grasa corporal radica en la regulación del metabolismo de la grasa a nivel intracelular. Aparentemente, una dieta baja en calcio conlleva a la disminución del calcio sérico, lo que aumenta el calcio intracelular en los adipositos, resultando en un aumento en la lipogénesis y disminución de la lipólisis, y por lo tanto, acumulación de grasa . Por el contrario, una dieta alta en calcio suprime el calcio intracelular, aumentando la termogénesis y reduciendo la acumulación de grasa.
En conclusión, el calcio dietético ayuda a proteger contra enfermedades crónicas como la osteoporosis, la hipertensión arterial, el cáncer, la litiasis renal y la obesidad. El calcio proveniente de los alimentos, especialmente de los productos lácteos, parece ser más efectivo en la prevención de estas enfermedades, posiblemente debido a la interacción con otros nutrientes presentes en estos alimentos. Para observar el efecto protector del calcio contra estas enfermedades no es necesario recomendar altas ingestas de calcio, ya que su efecto protector es evidente en los niveles recomendados para la mayor parte de la población, es decir, entre 1000 y 1300 mg diarios de calcio. Sin embargo, la ingesta adecuada de calcio con fines preventivos debe mantenerse en el tiempo y no como una intervención puntual.