Con el fin de estimar la prevalencia de deficiencia de vitamina A en niños con desnutrición moderada, se determinó la concentración plasmática de retinol por HPLC y se realizó la prueba de dosis respuesta relativa (RDR) a 124 niños menores de 10 años de edad atendidos en el Centro de Atención Nutricional Infantil Antímano. Luego de una noche de ayuno, a cada niño se le tomaron muestras de sangre para la realización de las pruebas bioquímicas. La evaluación médica puso énfasis en la detección de signos clínicos de deficiencia de vitamina A y antecedentes respiratorios infecciosos recientes o diarrea. La adecuación del consumo de vitamina A en la dieta se determinó según el recordatorio del consumo de 24 horas. La concentración plasmática promedio de retinol fue de 28,6 µg/dL. De estos niños, 10,4% poseía valores por debajo de 20 µg/dL; asimismo, 10,6% de la muestra presentó valores de RDR superiores a 20%. Se observó una prevalencia de deficiencia mayor (21,2%, p<0,05) en los niños menores de dos años. No se observaron signos clínicos oculares específicos de deficiencia de vitamina A. Se encontró una relación significativa (p<0,05) entre catarro común o neumonía y retinol plasmático, mas no entre diarrea y retinol plasmático. La adecuación promedio de consumo de vitamina A fue de 121,2%. En la población infantil estudiada se detectó un problema de deficiencia subclínica de vitamina A. La magnitud de la deficiencia es mayor en niños menores de dos años, lo cual requiere especial atención. En general, este problema no requiere suplementación con vitamina A, pero debe ser solventado mediante la educación nutricional de la población.
Palabras clave: Vitamina A, niño, desnutrición proteico-energética, deficiencia de vitamina A, factores socioeconómicos, Venezuela, América Latina.
Inolder to estimate the prevalence of vitamin A deficiency in children with malnutrition, plasma retinol concentration was measured by HPLC, and the relative dose response test (RDR) was applied to 124 children of both sexes and under 10 years of age attended at the Centro de Atención Nutricional Infantil Antímano. After a night of fasting, a blood sample was taken from each child. The medical evaluation emphasized the detection of clinical signs of vitamin A deficiency and recent respiratory and infections history or diarrhea. The adequacy of dietary vitamin A intake was determined by a 24 hour intake recall. The mean of plasma retinal concentration was 28.6 µg/dL; 10.4% had plasma retinol under 20 µg/dL; also, 10.6% of the sample showed RDR values higher than 20%. A higher prevalence was observed in children under 2 years of age (21.2%, p<0.05). In these children, ocular clinical signs of vitamin A deficiency code absent there was a significant relation between a pneumonia history and plasma retinol concentration, but there was no relation between diarrhea and plasma retinal concentration. The mean of vitamin A adequacy intake was 121.2%. These results pointed to the existence of subclinic vitamin A deficiency in the population studied. The severity of the deficiency was higher in children under 2 years of age and requires special attention. This problem did not require vitamin A supplementation, but should be resolved by the nutritional education of the population.
Key words: Vitamin A, child, protein-energy malnutrition, vitamin A deficiency, socioeconomic factors, Venezuela, Latin America.
La vitamina A fue la primera de las vitaminas liposolubles en ser descubierta (McCollum y Davis en 1913). El término genérico de vitamina A abarca los ésteres del holo-trans-retinol, el retinal, que participa en el ciclo visual, y el ácido retinoico y sus metabolitos, con innumerables funciones que van desde su intervención en la diferenciación celular hasta el mantenimiento de la integridad de la función inmune y en la embriogénesis (1).
Uno de los desórdenes funcionales de deficiencia de vitamina A mejor descrito es la xeroftalmia, hasta el punto que constituye un indicador tanto de la deficiencia de vitamina A, como de la magnitud de dicha deficiencia. La xeroftalmia afecta cada año a 8 - 10 millones de niños en el tercer mundo, de los cuales al menos 250.000 quedan ciegos a consecuencia de esa dolencia.
Sin embargo, varios estudios epidemiológicos indican que las consecuencias de la deficiencia de vitamina A superan el daño ocular. En los últimos veinte años, se ha asociado el déficit subclínico de vitamina A con alteraciones funcionales en el individuo, principalmente en los niños, que afectan las tasas de morbilidad, de mortalidad y el crecimiento. Varios estudios han asociado un estado deficitario de vitamina A con un incremento en el riesgo de sufrir infecciones respiratorias y diarrea, aunque tal asociación también puede ser consecuencia de la respuesta de fase aguda a la infección, por lo que se habla de un círculo vicioso de deficiencia de vitamina A - infección (2).
Estos estudios han generado un creciente interés en América Latina y el Caribe por la problemática de deficiencia marginal o subclínica de vitamina A, de alta prevalencia en varios países de la región (3).
En Venezuela hasta la fecha no existe un solo trabajo a escala nacional sobre la situación nutricional de vitamina A en la población infantil (3), existen unos pocos estudios recientes circunscritos a la población infantil de algunas regiones del país. En ese sentido, la mayoría de los datos corresponden a niños entre 1 y 6 años de edad, desnutridos y eutróficos, comprendiendo casi exclusivamente estimaciones de prevalencia de valores bajos de retinol plasmático; pocos de estos estudios incluyen información de consumo de vitamina A (4-6).
Solano y colaboradores (4), en Valencia, con niños menores de 7 años observaron una prevalencia de deficiencia subclínica de vitamina A (retinol plasmático <= 20 µg/dL) de 6,5%; este mismo grupo de investigación reportó recientemente, en un estudio realizado en 1998, una prevalencia de deficiencia de vitamina A aún más baja en niños de 2 a 15 años no desnutridos de la misma zona (0,7%), la mas baja reportada en el país para la población infantil (6). En Barquisimeto, Montilva y colaboradores encontraron una prevalencia de 14% en niños menores de 7 años (7). En el otro extremo del espectro, el estudio realizado entre 1996 y 1997sobre los resultados del programa de fortalecimiento de las harinas, halló una elevada prevalencia de deficiencia, 60%, en niños menores de 3 años de Caracas (5); igual de elevada es la prevalencia detectada por Rodríguez y colaboradores en 1995 (8), también en Caracas, en niños menores de 5 años. Otros autores han encontrado prevalencias intermedias (25% - 40%) en niños menores de 11 años de Valencia entre 1995 y 1996 (9), menores de 6 años de Canaguá (Estado Mérida) (10) y menores de 6 años de la isla de Coche en el año 1995 (11).
Dada la inexistencia de una estimación nacional del estado de vitamina A en la población infantil y que la información de prevalencia de deficiencia subclínica de vitamina A en algunas poblaciones infantiles indica la existencia de un problema de salud pública, se hizo necesario estimar la magnitud de la deficiencia marginal o subclínica de vitamina A en los niños con desnutrición moderada que asisten al Centro de Atención Nutricional Infantil Antímano (CANIA) procedentes de la población de Antímano; comunidad menos privilegiada cuyos problemas nutricionales son atendidos por el CANIA.
Conocer el estado de vitamina A en esta población pediátrica, permitirá formular estrategias de intervención y prevención que disminuyan el impacto negativo de la deficiencia subclínica de vitamina A sobre el estado de salud y el desarrollo del niño.
El grupo de estudio consistió en 124 niños (49 hembras, 75 varones) menores de 10 años con desnutrición moderada atendidos en la modalidad de seminternado del CANIA, provenientes de una comunidad menos privilegiada de la Parroquia Antímano (Caracas). Se excluyeron aquellos casos en los cuales el cuadro de desnutrición estaba asociado a una patología orgánica crónica. El estudio se realizó entre enero de 1999 y abril de 2000.
Luego que los representantes de los niños fueron informados sobre los detalles y objetivos del trabajo se obtuvo su consentimiento por escrito.
La clasificación del estado nutricional se hizo basándose en el método de combinación de indicadores de dimensión corporal tradicionales: Peso para la Edad, Talla para la Edad y Peso para la Talla (12).
La situación socioeconómica del grupo familiar de cada niño fue evaluada según el método Graffar modificado por Méndez Castellano (13).
En las muestras de plasma de los niños en ayuno se determinó la concentración de retinol por cromatografía líquida de alto rendimiento (HPLC). Descrito brevemente, el procedimiento fue el siguiente: se tomaron 500 µL de plasma y se sometieron a dos extracciones con hexano, se reunieron los sobrenadantes y se evaporaron a sequedad bajo corriente de nitrógeno. El extracto lipídico fue resuspendido en 100 µL de etanol y 300 µL de metanol:diclorometano:acetonitrilo (10:20:70) y se inyectaron 20 µL en el sistema HPLC. La separación del retinol se realizó utilizando un sistema Hewlett Packard Series 1100 con una columna hypersil ODS C18 (longitud 25 cm, diámetro interno de 4 mm, tamaño de partícula 5 µm), el retinol se eluyó con una mezcla metanol:acetonitrilo (60%:40%) a 0,4 mL/minuto y se cuantificó midiendo la absorbancia del eluente a 322 nm. Se utilizó retinil acetato como estándar interno. Todos los solventes utilizados fueron grado HPLC, excepto el etanol que fue grado analítico. Se consideró 20 µg/dL como el punto de corte para definir deficiencia marginal de vitamina A.
La prueba dosis respuesta relativa (RDR) se realizó tal como ha sido descrita utilizando una dosis de 900 µg de equivalentes de retinol (retinil palmitato en jugo de manzana), se utilizó 20% como punto de corte para definir deficiencia de vitamina A (14).
A los niños se les midió la concentración de proteínas en suero: proteínas totales (15), albúmina (16) ambas medidas en un autoanalizador Express Plus (Ciba - Corning), prealbúmina (17) medida en un Turbox (Orion Diagnostica) y proteína C reactiva (PCR) (17). Los puntos de corte utilizados para las proteínas séricas fueron: proteínas totales < 6 g/dL (18), albúmina < 3,5 g/dL (19), prealbúmina < 20 mg/dL (19) y PCR > 0,8 mg/dL.
También se realizó la determinación de inmunoglobulinas (IgG, IgM, IgA), C3 y C4, en suero, medidas por nefelometría en un Turbox (Orion Diagnostica). La inmunoglobulina E (IgE) se midió por quimioluminiscencia en un ACS:180 (Bayer Corporation) (20). Los puntos de corte empleados para las inmunoglobulinas y proteínas de complemento fueron: IgA < 0,24 g/L para menores de 4 años, < 0,26 g/L en niños entre 4 a 6 años y < 0,33 g/L para niños mayores de 7 años (21). IgG < 4 g/L para niños menores de 4 años, < 5,6 g/L para niños entre 4 a 6 años y < 5,98 g/L para niños mayores de 7 años (21). IgM < 0,35 g/L en menores de 2 años, < 0,41 g/L en niños entre 2 a 3 años y < 0,47 g/L para niños mayores de 4 años y < 0,56 g/L para niñas mayores de 4 años (21). IgE > 52,3 UI/mL para niños menores de 1 año, > 351,6 UI/mL para niños entre 1 año y menores de 5 años y > 393 UI/mL para niños con edad mayor o igual a 5 años (valores de referencia del ACS:180, Bayer Corporation). C3 < 0,6 g/L para menores de 1 año y < 0,8 g/L entre 1 a 10 años (21). C4 < 0,07 g/L hasta 6 meses de edad y < 0,10 g/L para mayores de 6 meses de edad (21).
<Ésta se dirigió principalmente a la detección de signos clínicos de deficiencia de vitamina A, principalmente manifestaciones oculares: xerosis conjuntival, manchas de Bitot y xerosis corneal. También se registró el número, frecuencia y tipo de cuadros infecciosos gastrointestinales y respiratorios agudos durante el año anterior a su ingreso en el CANIA, esta información se clasificó en períodos de tres meses.
A los niños se les tomó una muestra de heces que se analizaron en fresco para identificar microscópicamente parásitos intestinales con el objetivo en 10X y 40X. En algunos casos se realizaron pruebas de concentración por el método formol-tritón-éter.
El consumo de alimentos de los niños del estudio se obtuvo a través de tres métodos de recolección de la información: recordatorio de 24 horas, frecuencia de consumo de alimentos semanal y frecuencia de consumo semanal de alimentos ricos en vitamina A. El recordatorio de 24 horas registró mediante una encuesta todos los alimentos y bebidas consumidos en el lapso de las últimas 24 horas anteriores a la consulta. La entrevista la realizó un nutricionista estandarizado en el protocolo. Se utilizaron modelos de alimentos y medidas prácticas para mejorar la estimación del tamaño de las raciones (18, 22 - 24). La adecuación nutricional del consumo de 24 horas para un nutriente dado se definió como la comparación porcentual entre la cantidad del nutriente consumido al día y los requerimientos individuales para ese nutriente (18, 25). Se consideró consumo adecuado aquel que se ubicaba entre el 85% y el 115% de los requerimientos diarios de calorías, macronutrientes y micronutrientes, respectivamente (26), basados en el cálculo del requerimiento individual para calorías y macronutrientes y según las RDA (Recommended Dietary Allowances) para los requerimientos de micronutrientes (27). La estimación del consumo de nutrientes se realizó a partir de los datos de los alimentos consumidos, utilizando el programa diseñado en CANIA denominado ARNAC (Alimentación Requerimiento Nutricional Adecuación CANIA) para el cálculo de los requerimientos, de la cantidad de nutrientes consumidos por día, así como de su adecuación. ARNAC está basado primordialmente en los datos de la tabla de composición de alimentos de 1999 del Instituto Nacional de Nutrición de Venezuela (28), pero para aquellos alimentos que no aparecen en esa tabla se emplearon como referencia tablas internacionales.
La frecuencia de consumo de alimentos semanal midió el número de días a la semana que el niño consumió los alimentos de cada uno de los grupos considerados: 1) lácteos, 2) vegetales, 3) frutas, 4) cereales, 5) carnes y 6) grasas (29).
Para medir la frecuencia de consumo, diaria y semanal, de alimentos ricos en vitamina A, se elaboró una lista de 67 alimentos seleccionados entre los 6 grupos de alimentos anteriormente descritos, tomando en cuenta aquellos que aportan una mayor cantidad de vitamina A (según la Tabla de Composición de Alimentos del Instituto Nacional de Nutrición, 28).
Con el fin de estimar la relación del sexo o la edad con el estado de vitamina A, los datos se agruparon para el análisis por sexo o por grupos de edad. La homogeneidad de las varianzas se comprobó según la prueba de Levene; luego, las diferencias entre medias fueron determinadas según ANOVA a p < 0,05. Se utilizó la prueba t de Student, al mismo nivel de confianza, para el caso particular de comparación entre un par de medias. Para establecer el grado de relación que existía entre vitamina A plasmática y las variables cuantitativas del estudio se calculó el coeficiente de correlación de Pearson. La prueba de Chi cuadrado de Pearson evaluó la asociación entre la categorización del retinol plasmático (mediante el uso del punto de corte para concentración plasmática o de la prueba RDR) y las variables cualitativas del estudio. Para el análisis estadístico se utilizó el programa SPSS para Windows versión 9.0.
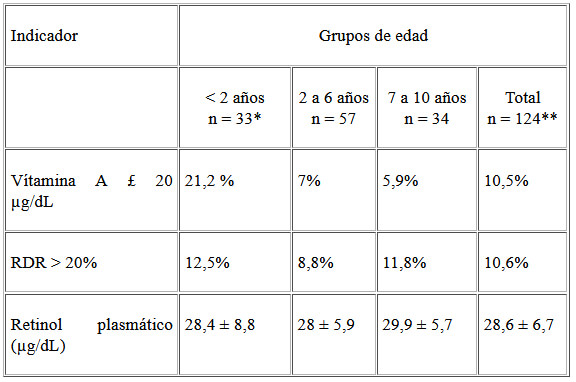
La concentración plasmática promedio de retinol en el grupo de estudio fue de 28,6 µg/dL, no se detectaron diferencias significativas entre sexos ni entre grupos de edad: < 2 años, 2 – 6, 7 – 10 años para una p < 0,05 (Cuadro 1). En particular, no se halló correlación estadística significativa entre el retinol plasmático y la edad. Sin embargo, la prevalencia de deficiencia de vitamina A, niños con valores de retinol plasmático por debajo de 20 µg/dL, fue significativamente mayor en los niños menores de 2 años (21,2%) que en los niños de 2 a 10 años (6,6%).
De todos los niños, 10,5% poseía valores de retinol plasmático por debajo de los 20 µg/dL; asimismo, 10,6% de la muestra presentó valores de RDR superiores a 20%, indicativo de deficiencia de vitamina A (Cuadro1). A pesar de que ambos valores de prevalencia de deficiencia de vitamina A fueron muy parecidos, no identificaron a los mismos individuos bajo riesgo. Ambas pruebas coincidieron en detectar deficiencia en un mismo individuo en 30,8% de los casos.
Cuando comparamos la concentración promedio de retinol plasmático de los niños deficientes de vitamina A por RDR con los no deficientes: 23,7 µg/dL y 29,1µg/dL, respectivamente, la diferencia fue significativa (p < 0,05).
Más de la mitad de las familias de los niños de la muestra pertenecía al estrato IV (52,4%), 38,1% al estrato V y 9,5% al estrato III. No se encontró asociación entre el nivel socioeconómico de la familia del niño y los valores de retinol plasmático o la prevalencia de deficiencia de vitamina A.
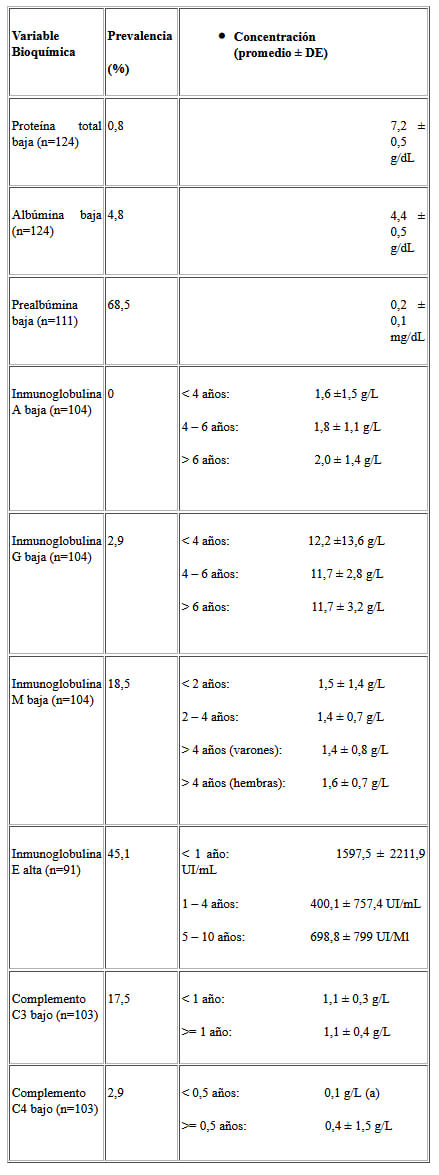
No se observaron alteraciones de las proteínas totales y la albúmina. En contraposición, la prealbúmina mostró una prevalencia de deficiencia elevada (Cuadro 2). Sólo un niño presentó valores de PCR por encima de 0,8 mg/dL, indicador de un proceso inflamatorio; sin embargo, se halló un1a correlación negativa entre la concentración de PCR y la concentración de retinol plasmático (r = -0,262, p < 0,05, n = 62).
Tanto IgG como IgA presentan prevalencias de valores bajos menores al 3%, mientras que la prevalencia de valores bajos de IgM en estos niños fue de considerable magnitud (Cuadro 2). En sentido inverso, la prevalencia de valores de IgE por encima del punto de corte para edad y sexo fue elevada (Cuadro 2). Las concentraciones de IgG, IgA e IgM mostraron una fuerte correlación positiva entre si (r mayor a 0,5, para p < 0,05). Además, se encontró correlación negativa entre los valores de retinol plasmático con IgG (r=- 0,21, p<0,05) e IgA (r= -0,23, p<0,05).
En ninguno de los niños se observaron signos clínicos oculares específicos de deficiencia de vitamina A (xerosis conjuntival, manchas de Bitot y xerosis corneal).
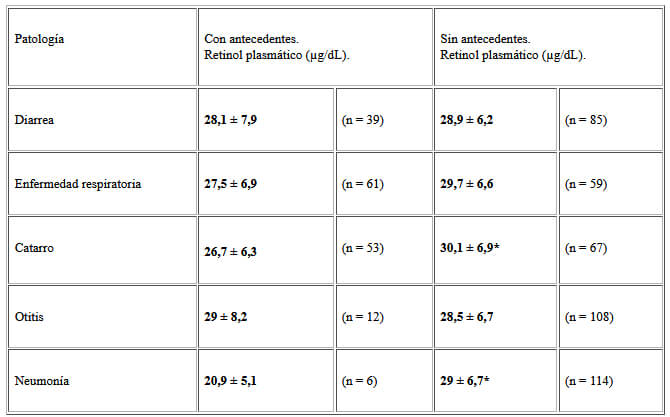
La mayor incidencia de enfermedades respiratorias correspondió a catarro común (44,2%), seguido por otitis (10%) y neumonía (5%), ningún representante reportó casos de bronconeumonía padecidos por los niños durante el año anterior al ingreso al estudio. Sólo 31,5% de los representantes recordaron que el niño había sufrido episodios de diarrea durante el año anterior al estudio. No se encontró relación estadísticamente significativa entre antecedentes de diarrea y retinol plasmático, ni entre antecedentes de enfermedades respiratorias en general u otitis en particular y concentración de retinol plasmático. Sin embargo, antecedentes de catarro o neumonía si fueron encontrados asociados significativamente con la concentración de retinol plasmático (Cuadro 3). El 96,2% (n = 51) de los niños con antecedentes de catarro lo padecieron en los últimos tres meses. Además, se encontró diferencia significativa en la concentración de retinol plasmático entre los niños con más de un episodio de catarro y los que no tuvieron antecedentes (24,1 µg/dL contra 30,1 µg/dL). Mientras no se encontró diferencia significativa entre los niños sin antecedentes y los que registraron un solo episodio (p < 0,05).
Cuarenta por ciento de los 65 niños a los que se les tomó muestra de heces presentaron parasitosis intestinal, de éstos: 20% estaban infestados con Giardia lamblia, 12,3% con Ascaris lumbricoides, 9,2% con Trichuris trichiura y 3,1 % con Blastocistis homini. Entamoeba coli, Enterobius vermicularis, Endolimax nana y Entamoeba histolitica fueron observados sólo en un caso cada uno (1,5%).
Se observó infestación por varias especies de parásitos en 10,7% de los casos. La concentración de retinol plasmático fue mas baja en los niños con parásitos intestinales (27,4 ± 6,4 µg/dL) que en los niños en los que no se encontró parásitos (29,2 ± 7,7 µg/dL), sin embargo, esta diferencia no fue significativa estadísticamente. De igual forma, los niños infestados con G. lamblia presentaron valores mas bajos de retinol plasmático (25,1 ± 5,9 µg/dL), que niños sin parasitosis (29,2 ± 7,7 µg/dL) o infestados con otra especie de parásito (29,7 ± 6,3 µg/dL), estas diferencias tampoco fueron estadísticamente significativas. En general no hubo diferencias significativas en la prevalencia de deficiencia de vitamina A (concentración de retinol plasmático por debajo de 20 µg/dL) entre niños con parasitosis intestinal (15,4%) y sin parasitosis intestinal (12,8%). En cambio, la diferencia entre la prevalencia de deficiencia de vitamina A medida por RDR entre niños con parasitosis (7,7%) y sin parasitosis (20,5%) fue mayor, pero tampoco alcanzó significancia estadística.
El promedio de adecuación de calorías y macronutrientes del total de niños de la muestra fue adecuado (entre 85% - 115%), medido por el recordatorio de 24 horas, mientras que la adecuación de vitamina A se encuentra por encima de la norma (115%) (Cuadro 4). El grupo de menores de 2 años siguió este comportamiento global, en tanto que el grupo 2 a 6 años presentó consumo hipocalórico, hipograso e hipoglucídico, adecuaciones significa-tivamente diferentes de las adecuaciones del grupo de niños menores de 2 años. El grupo de 7 a 10 años presentó valores de adecuación en el consumo de lípidos por debajo de 85%, significativamente diferente de la adecuación de lípidos del grupo de niños menores de 2 años. La adecuación de vitamina A fue normal, excepto en el grupo de menores de 2 años que alcanza un valor de 164,4%, aunque este valor no es diferente significativamente de los valores de adecuación de vitamina A de los otros grupos de edad. Sin embargo, una gran proporción (47,6%) de los niños de toda la muestra presentó un consumo subóptimo de vitamina A (por debajo de una adecuación de 85%). La variabilidad interindividual en el consumo de vitamina A fue elevada, con el valor mínimo en 0,2% y el máximo en 757,5%.
La adecuación fue calculada como el porcentaje del requerimiento cubierto por el consumo del nutriente, tomando en cuenta las necesidades según edad y sexo basados en el cálculo del requerimiento individual para calorías y macronutrientes, y según las RDA para los requerimientos de vitamina A (27).
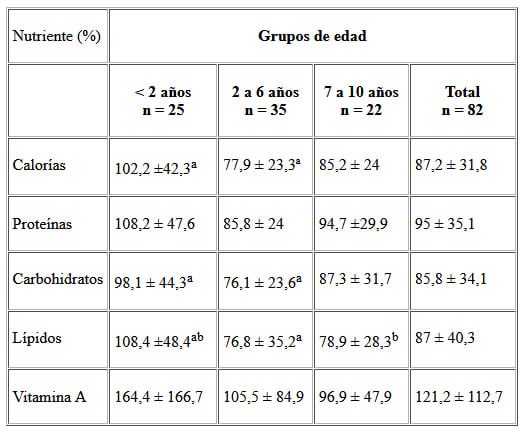
La adecuación fue calculada como el porcentaje del requerimiento cubierto por el consumo del nutriente, tomando en cuenta las necesidades según edad y sexo basados en el cálculo del requerimiento individual para calorías y macronutrientes, y según las RDA para los requerimientos de vitamina A (27).
El promedio de consumo diario de vitamina A por grupos de edad, calculado a partir de la encuesta de frecuencia de consumo semanal, superó de dos a cinco veces el requerimiento diario. Los grupos de alimentos que aportaron una mayor cantidad de vitamina A, clasificados por grupos de edad fueron: en los menores de 2 años los lácteos, cereales y vegetales, si se excluyen los cereales enriquecidos con vitamina A este orden se modifica y los vegetales suben el segundo lugar y la carne ocupa el tercero. En el grupo de 2 a 6 años fueron: vegetales, carnes y leche y en el grupo entre 7 y 10 años fueron: carnes, cereales y frutas, modificándose a carnes, frutas y vegetales si se eliminan los cereales enriquecidos.
Los alimentos ricos en vitamina A de mayor consumo por la población en estudio fueron los siguientes, en orden de frecuencia: leche en polvo completa, auyama, zanahoria, pimentón, tomate, cambur, guayaba, mango, lechosa, melón, harina de maíz, plátano, harina de arroz, hojuelas de maíz, queso blanco, huevo, hígado de res e hígado de pollo, margarina y salsa de tomate.
Estos resultados señalan la existencia de un problema de deficiencia subclínica de vitamina A en la población de niños con desnutrición moderada que son atendidos en CANIA. La prevalencia de deficiencia subclínica de vitamina A detectada en este grupo de niños, estimada por dos indicadores bioquímicos de estado de vitamina A, se clasifica como un problema leve de salud pública según los criterios de la OMS (30), más aún cuando se trató de niños comprometidos nutricionalmente. De mayor interés fue la elevada prevalencia de deficiencia subclínica de vitamina A, según retinol plasmático (< 20 µg/dL), en los niños menores de 2 años, un problema grave para este grupo de edad. Aunque en ambos casos, tanto en el grupo menor de 2 años como en todos los niños de la muestra, la prevalencia de deficiencia de vitamina A según RDR estuvo muy por debajo del 20%, punto de corte que indica un problema leve de salud pública, según la OMS (30).
Bajo las condiciones del presente trabajo y el rango de edades estudiado, la mayor prevalencia en el grupo de niños menores de 2 años no se encontró asociado a un efecto de la edad sobre la concentración plasmática de retinol, como ha sido reportado por otros autores (31).
Tanto el valor promedio de concentración de retinol plasmático como la prevalencia de deficiencia de vitamina A en el grupo estudiado fueron similares a los reportados recientemente para niños menores de 7 años de comunidades suburbanas de Barquisimeto, 27,1 µg/dL y 14%, respectivamente (7).
Los métodos bioquímicos de evaluación de vitamina A empleados en el presente trabajo, retinol plasmático y la prueba RDR, detectaron un mismo grado de deficiencia a escala poblacional a pesar de que no identificaron a los mismos individuos en riesgo de deficiencia marginal, resultados similares han sido observados por otros autores (32,33). Empleando los mismos puntos de corte para definir deficiencia de vitamina A según RDR y retinol plasmático, Makdani y col. (33) hallaron 35 niños con un estado de vitamina A inadecuado según RDR y 33 según la concentración de retinol plasmático, pero únicamente 11 niños fueron identificados como deficientes por ambas pruebas, lo que representa una coincidencia de 30% de los casos, porcentaje muy similar al encontrado en el presente estudio.
Al igual que en otros trabajos (32,34), la diferencia significativa entre el promedio de retinol plasmático de los niños con valores de RDR mayor o igual a 20% y de los niños con RDR menor de 20% indica que ambas pruebas bioquímicas están relacionadas y permiten discriminar grupos con características diferentes en su estado de vitamina A. Lo contrario no fue cierto, es decir, al clasificar en dos grupos el estado de vitamina según retinol plasmático los promedios de RDR no resultaron diferentes significativamente; pero ya ha sido reportado que los valores de RDR no están relacionados linealmente con la concentración de retinol, sobre todo cuando los valores de retinol se encuentran en el rango entre 20 – 30 µg/dL (35).
Ahora bien, aproximadamente 70% de los niños que resultaron deficientes en vitamina A por una de las dos pruebas no fue deficiente según la otra. Esto conlleva a preguntarse cuál de las dos pruebas detectó con mayor especificidad un estado deficitario de vitamina A. Se conoce que la prueba RDR discrimina mejor el estado de vitamina A del individuo pues es un estimador indirecto de las reservas hepáticas de retinol, mientras que la concentración plasmática de retinol está supeditada a un control homeostático y sólo disminuye cuando las reservas hepáticas están agotadas (14, 36). No obstante, en general, la medida de la concentración de retinol plasmático es recomendada por la OMS para establecer prevalencias de déficit de vitamina A a escala de poblaciones (30, 37).
Los valores de RDR pueden estar influenciados por la magnitud de la absorción del retinil palmitato en el intestino o por la cantidad de ésteres de retinol tomados por el hígado a las cinco horas de administrada la dosis de retinil palmitato.
Makdani y colaboradores (33), al emplear la prueba RDR en niños entre 2 y 8 años, encontraron una elevación en sangre de los ésteres de retinol a las cinco horas de ingerida la dosis de retinil palmitato, basándose en este hallazgo esos autores sugieren que tal vez la cantidad de ésteres de retinol tomados por el hígado haya sido insuficiente a las cinco horas como para ocasionar una liberación de retinol ligado a la proteína de unión a retinol (RBP) de tal magnitud que permitiera detectar deficiencia en aquellos individuos deficientes. Como en el presente trabajo no se midieron los ésteres de retinol en plasma, no es posible dilucidar si una situación similar a la reportada por Makdani y colaboradores haya influenciado la respuesta a la dosis de retinil palmitato en este trabajo.
También se debe indicar que debido a que el 40% de los niños del presente estudio presentó parasitosis intestinal y se conoce que algunas especies de parásitos interfieren en la absorción intestinal (32, 38), especialmente G. lamblia (39) que representó el 50% de las parasitosis intestinales de los niños en este trabajo. Es posible que la parasitosis intestinal haya reducido la absorción normal de la dosis de retinil palmitato, conduciendo a una subestimación de la deficiencia en la población. Esto parece ser sugerido por la menor prevalencia de deficiencia de vitamina A, según RDR, en los niños con parasitosis con respecto a los niños sin infestación parasitaria, aunque esta diferencia no alcanzó significancia estadística.
Varios estudios han sugerido un aumento en la dosis de retinil palmitato (32), sobre todo en los casos en que se sospeche una alta prevalencia de parasitosis intestinal. También se ha recomendado un aumento del lapso de tiempo en que se tome la segunda muestra de sangre pues la absorción intestinal y procesamiento en el hígado de la dosis de retinil palmitato aún pudiera ser insuficiente a las 5 horas (33). Sin embargo, debido al tipo de diseño experimental del presente trabajo no fue posible determinar si alguno de estos factores afectó los resultados de la prueba RDR y por ende no se pudo discriminar cuál de las dos pruebas bioquímicas detectó con mayor especificidad el estado de vitamina A de los niños.
De igual forma, por su efecto sobre la capacidad absortiva del intestino, la infestación con parásitos intestinales ha sido asociada con bajos valores de retinol plasmático (40, 41); aunque en este trabajo se halló una concentración promedio de retinol más baja en niños con parásitos intestinales en general, o específicamente con A. lumbricoides o G. lamblia, tales diferencias no fueron estadísticamente significativas. Rodríguez y colaboradores (6) también encontraron una concentración promedio de retinol mas baja en niños infestados con G. lamblia, aunque no con A. lumbricoides; al igual que es nuestro trabajo los parásitos más frecuentes en el estudio de Rodríguez y colaboradores fueron G. lamblia y A. lumbricoides.
La elevada prevalencia de valores bajos de prealbúmina en desnutridos moderados ha sido ya reportada (42). Esta proteína sérica tiene una corta vida media (2 días) y es sensible a cambios agudos del estado nutricional, pues disminuye rápidamente cuando el consumo de proteínas y calorías baja repentinamente (43-45). Tanto las proteínas totales, como específicamente la albúmina, disminuyen en suero sólo cuando el déficit nutricional es grave y crónico (46, 47). La baja prevalencia de valores deficitarios de estas proteínas también concuerda con los valores reportados en otro estudio con desnutridos moderados de la misma población de Antímano (42).
La prevalencia de valores bajos de C3 y C4 observadas concuerdan con lo reportado en la literatura para niños con desnutrición grave a pesar del grado moderado de desnutrición de los niños del presente trabajo, pues los valores de C3 disminuyen en situaciones de desnutrición en tanto que la concentración de C4 permanece inalterada (48 – 50). Nuestros resultados son similares a los reportados recientemente en desnutridos moderados de la misma zona (42). Otros trabajos, no obstante, no han hallado diferencias en los niveles de C3 y C4 entre niños eutróficos y desnutridos moderados, más sí en grados graves de desnutrición (51). Rikimaru y colaboradores (51) encontraron correlación entre el grado de depleción de complemento y la gravedad de la depleción de otras proteínas plasmáticas. La disminución de la concentración de complemento en niños desnutridos puede deberse a un aumento de su gasto durante las infecciones o a una disminución de su síntesis (48).
La concentración sérica de IgE usualmente es elevada en estados de desnutrición, generalmente debido a parasitosis intestinal (48), ésto concuerda con la alta prevalencia de parasitosis y de valores elevados de IgE encontrados en este trabajo (Tabla 2). Sin embargo, difiere de lo reportado por Dini y Arenas (42), quienes en niños desnutridos moderados de la misma comunidad hallaron una prevalencia de valores elevados de IgE menor al 3%, a pesar de que el porcentaje de niños con parasitosis intestinal en ese trabajo fue similar al de nuestro estudio (40%).
En general, la concentración de inmunoglobulinas séricas no es afectada significativamente por la desnutrición moderada (51), aunque los valores pueden estar modulados por el estado nutricional y la presencia de infecciones (49). En ese sentido, la prevalencia de IgG e IgA medida en nuestro trabajo concuerdan con lo reportado para esta misma población (42). Sin embargo, la moderada prevalencia de valores deficitarios de IgM difiere de la muy baja prevalencia de IgM hallada por Dini y Arenas (42). De las inmunoglobulinas y complementos, sólo las concentraciones de IgG e IgA parecen estar relacionadas con el retinol plasmático, por lo que tal relación debe ser estudiada.
En un trabajo realizado en Indonesia (52) y otro en la India (53) en poblaciones infantiles, menores de 5 años, con deficiencia clínica leve de vitamina A, se halló un incremento significativo en el riesgo de sufrir infecciones respiratorias en aquellos niños con deficiencia de vitamina A con respecto a los niños sin signos de deficiencia. De igual forma, Sommer y colaboradores en Indonesia (54), encontraron que aquellos niños con historia de infección respiratoria o diarrea tenían un mayor riesgo de desarrollar xeroftalmia. Aunque en el presente trabajo no se encontró asociación entre estado de vitamina A y enfermedades respiratorias en general, si se halló una asociación entre antecedentes de catarro común y neumonía y la concentración de retinol plasmático; aunque no fue posible, sin embargo, debido al carácter transversal de nuestro estudio, establecer relaciones causales a dicha asociación. En este estudio esta asociación se estableció en niños donde no se detectaron casos clínicos de deficiencia de vitamina A, a diferencia de otros trabajos donde la deficiencia de vitamina A se definió por la presencia de signos clínicos. La correlación negativa entre PCR y retinol plasmático sugiere, a pesar de que sólo un niño presentó valores de PCR por encima del punto de corte, una relación entre estado inflamatorio y estado de vitamina A (55). Por último, es necesario indicar que el estado nutricional general de los niños pudo incidir en su susceptibilidad a las infecciones respiratorias, aunque en otros estudios no se halló efecto alguno, o uno muy pequeño, del estado nutricional general de los niños sobre el riesgo de sufrir enfermedades respiratorias o diarrea (52, 54).
En el presente trabajo no se encontró asociación significativa entre diarrea y retinol plasmático a diferencia de otros estudios (52, 56). Sin embargo, otros trabajos (8, 53) tampoco han hallado relación entre estado de vitamina A y diarrea. Muchos factores pueden influenciar el grado de relación entre diarrea y estado de vitamina A como pueden serlo la intensidad de la desnutrición, edad de los pacientes, definición de diarrea y modo de recolección de la información sobre la diarrea. Por último, hay que recordar la elevada prevalencia de parasitosis intestinal (40%) que puede condicionar diarreas sin relación al estado de vitamina A del niño.
Los alimentos de mayor consumo reportados en este trabajo son similares al patrón de consumo alimentario de la población infantil atendida en CANIA determinado en un estudio realizado en esta institución en 1997 (57) donde se encontró que los 15 alimentos de consumo más frecuentes según una encuesta de frecuencia de consumo fueron: harina de maíz, azúcar, leche en polvo completa, queso blanco, arroz, margarina, aceite, pasta, pollo, carne de res, plátano maduro, huevo, café, tomate y cebolla; en particular, dentro del grupo de vegetales la zanahoria ocupó el tercer lugar y la guayaba fue la fruta más consumida en este grupo de estudio. Igualmente corresponde al patrón de consumo del área urbana de Caracas, en una investigación realizada por Fundacredesa, en la cual se observa que el cambur, la lechosa, la margarina, la harina de maíz, el plátano, la cebolla, tomate y auyama son los alimentos de mayor consumo (58).
Los valores elevados de consumo de vitamina A medidos por las encuestas nutricionales generalmente sobrestiman el consumo real, pues dependen de la biodisponibilidad del micronutriente en los alimentos, sobre todo cuando la fuente de vitamina A son alimentos de origen vegetal no fortificados. Además, en este trabajo se utilizó el factor clásico de conversión de ?-caroteno a retinol de 6 µg de ?-caroteno por 1 µg de retinol (59). Recientemente, se ha cuestionado la validez de este factor de conversión (60, 61). En 2001, las referencias dietéticas de consumo de Estados Unidos y Canadá proponen la conversión de 12 µg de ?-caroteno por 1 µg de retinol y 24 µg de otros carotenoides (?-caroteno y ?-criptoxantina) por 1 µg de retinol (62).
De tal forma que un cambio en el factor de conversión en ese sentido disminuye el aporte de retinol calculado a partir de alimentos de origen vegetal aproximadamente a la mitad, lo que conlleva a una reducción de la adecuación. Así que el porcentaje de niños con consumo deficiente de vitamina A calculado en este estudio probablemente sea muy superior al 50%.
La alta variabilidad de consumo de vitamina A se debió al empleo del recordatorio de 24 horas como método de recolección de la información de consumo, pues al ser pocos los alimentos ricos en vitamina A, su consumo generalmente no es consuetudinario, por lo que el recordatorio de 24 horas tiende a registrar altas variaciones en el consumo de vitamina A entre individuos dependiendo si éstos habían consumido el día anterior a la entrevista alimentos ricos en vitamina A o no. También, aunque en menor medida, la subjetividad del encuestado al estimar la cantidad de alimento consumido contribuye a sesgar la estimación del consumo (62).
Por último, la adecuación alta de vitamina A en los niños menores de 2 años (164%) está determinada por el consumo de leche, específicamente leche completa en polvo, que en Venezuela está enriquecida con vitaminas A y D.
Estos resultados señalan la existencia de un problema leve de deficiencia subclínica de vitamina A en la población de niños con desnutrición moderada estudiada. La gravedad de la deficiencia es mayor en el grupo de niños menores de dos años, por lo que este grupo de edad debe ser considerado con especial atención. En particular, al realizar la evaluación del estado de vitamina A en niños, se debe tomar en cuenta la alta prevalencia de parasitosis intestinal y las infecciones respiratorias.
En general, siguiendo las recomendaciones de la OMS (30), este problema no requiere suplementación con vitamina A, pero debe ser solventado mediante la educación nutricional de la población.
A Laboratorios Roche por la gentil donación del retinil palmitato utilizado en la prueba RDR. A la Lic. Edihovert Nahr por la evaluación socioeconómica de las familias de los niños. A las bioanalistas Oswfrany Toro y Magda González por la realización de las pruebas de química sanguínea. A la Sra. Oliva Rico por la toma de las muestras de sangre y a las enfermeras Teresa González, Deisy Ayala y Angela Cisneros por la ayuda en la atención y cuidado de los niños.
Este trabajo fue financiado parcialmente por el Programa del Investigador Novel del CONICIT y el programa de Fortalecimiento de Centros de Investigación del CONICIT Nº F-97000910.
Recibido: 23-03-2001
Aceptado: 28-06-2002