El objetivo del trabajo fue conocer las alteraciones en las pruebas de laboratorio en niños con desnutrición aguda moderada primaria. Se analizaron las siguientes variables: hemograma, proteínas totales y fraccionadas, índice creatinina/talla, hierro, porcentaje de saturación transferrina, calcio, fósforo, magnesio, fosfatasa alcalina, pruebas de funcionalismo renal, electrolitos, perfil lipídico e inmunológico humoral, coproanálisis y uroanálisis de 240 niños menores de 10 años. Mediante distribución de frecuencia por sexo y grupos de edad, se compararon las concentraciones promedios de las variables entre los niños y las niñas por "t" de Student (p< 0,05). Asimismo, se compararon los resultados con valores de referencia internacionales determinando la proporción de niños y niñas que presentaron alteraciones; la significancia estadística se estimó por Chi-Cuadrado (p<0,05). Se encontró diferencia significativa entre los sexos en proteínas totales y hierro en el grupo de 7 – 10 años (p< 0,025) e inmunoglobulina A en el grupo de 0 – 11meses (p< 0,05). Se encontró anemia en 29,6% en su mayor proporción ferropénica. Hipoalbuminemia: 5,8 %, prealbúmina baja: 55,1 %, déficit en el índice creatinina/talla (< 80%): 57,1%, hipocalcemia: 24,2% e hipomagnesemia: 8,2%. Colesterol total (26,3 %) y HDL-C (79%) bajos, triglicéridos (22,9%) y VLDL-C (14,5%) altos. Complemento C3 bajo en 10 %. Las pruebas que aportaron algún valor diagnóstico fueron: hemograma, porcentaje de saturación de transferrina; prealbúmina, C3 e índice creatinina/talla para estudiar el estado proteico; calcio, fósforo y fosfatasa alcalina para identificar el grado de raquitismo subclínico; magnesio, uroanálisis y coproanálisis.
Palabras clave: Bioquímica, niños, trastornos nutricionales.
The objective of this work was to determine alterations in the laboratory tests in children with primary moderate malnutrition. To following variables of 240 children under 10 years age were analyzed: red blood cell indices, total and protein fractions, creatinine/height index, iron, transferrin saturation, calcium, phosphorus, magnesium, alkaline phosphatase, renal function tests, electrolytes, lipid and immunologic profile, urinalysis, stool test. Frequency distribution was carried out for sex and age groups and the mean concentrations were compared between boys and girls (Student t-test (p <0.05). Also these results were compared with international standards. Significant differences were found among the sexes in the total proteins and iron in the 7 to 10 year group (p <0.025) and inmunoglobulin A in the 0 to 11 months group (p <0.05). Anemia was found in children (29.6%), with a high proportion of iron deficiency. Hypoalbuminemia: 5.8%, a low prealbumin: 55.1%, a low creatinine/height index (<80%): 57.1%, a hypocalcemia: 24.2% and hypomagnesemia: 8.2%. Total cholesterol (26,3%) and low HDL-C (79%) tryglicerides (22.9%) and VLDL-C (14.5%) high. Complement C3 was low in 10% of children. The laboratory tests that diagnostic value included: anemia, prealbumin, creatinine/height index, calcium, phosphorus, alkaline phosphatase, magnesium, urinalysis and stool tests.
Key words: Child, hematologic tests, energy malnutrition.
Las pruebas de laboratorio son consideradas métodos diagnósticos exploratorios y complementarios de la clínica, porque proveen información para confirmar una hipótesis inicial, o para tomar decisiones en cuanto al manejo y tratamiento del paciente (1,2).
En la evaluación de los pacientes con déficit nutricional, las pruebas de laboratorio son utilizadas rutinariamente y junto con el examen físico, la evaluación antropométrica, dietética, psico-socio-económica y otras paraclínicas en el estudio de la desnutrición, se consideran buenas metodologías, pero tienen limitaciones en sensibilidad y especificidad (3). Aun así, las pruebas de laboratorio son de gran utilidad, porque inclusive la alteración de algunas de ellas, puede señalar la deficiencia de un nutriente de una manera precoz.
Las pruebas de laboratorio están sujetas a una serie de factores internos al individuo (estado de hidratación, ritmo circardiano, postura, estrés, interferencia con drogas, ayuno) y externos (contaminación de la muestra, dilución, calidad del reactivo, anticoagulante, hemólisis, control de calidad y calibración de los equipos y entrenamiento del personal técnico) que influyen en los resultados (4).
De allí que los datos del laboratorio deben ser utilizados e interpretados como un complemento de la clínica en la evaluación o seguimiento del estado nutricional de un individuo, porque todo diagnóstico debe ser una síntesis que se obtiene con el juicio clínico, y éste será más adecuado, cuanto más datos se hayan analizado para confirmar las hipótesis o sospechas.
Mientras mayor sea el grado de desnutrición, se espera un grado mayor de deficiencia de nutrientes. En desnutridos graves se han realizado muchos estudios (5-10) donde se han identificado las pruebas de laboratorio que están alteradas y los resultados de estos trabajos coinciden y sugieren además, el agotamiento de las reservas de nutrientes; pero los llevados a cabo en desnutridos de menor intensidad son pocos (7,8,11) y los resultados de las pruebas de laboratorio en ocasiones son controversiales entre los estudios e inconsistentes con la intensidad del déficit nutricional (5), porque todavía no está disponible una prueba de laboratorio que identifique exclusivamente el estado nutricional, ya que las actuales están sujetas no sólo a la deprivación del nutriente, sino también a los efectos de enfermedades intercurrentes, a los factores externos mencionados antes y además, la mayoría de las pruebas tienen amplios límites de confiabilidad que las hacen más apropiadas para estudios epidemiológicos que individuales (12), de allí la razón para investigar los hallazgos en las pruebas de laboratorio de los niños con desnutrición moderada.
El objetivo de este trabajo fue identificar las alteraciones más importantes en las pruebas de laboratorio en niños con desnutrición aguda moderada primaria atendidos en el Centro de Atención Nutricional Infantil de Antímano (CANIA) para establecer el perfil de laboratorio efectivo para estos pacientes.
Se revisaron las historias de 240 niños menores de 10 años, 115 niños y 125 niñas, con diagnóstico de desnutrición aguda moderada primaria de acuerdo con el diagnóstico nutricional integral (13) quienes fueron ingresados al seminternado del CANIA entre 1995 y 1996. La distribución por grupos de edad fue la siguiente: 26 niños y 27 niñas de 0 a 1 año 11 meses, 62 niños y 66 niñas de 2 a 6 años 11 meses y 27 niños y 32 niñas entre 7 a 10 años 11 meses.
Para establecer el diagnóstico antropométrico se utilizó el método de combinación de indicadores de dimensión (14) utilizando como referencia las tablas de la OMS (15).
En el momento del ingreso al Centro a cada niño se le realizaron en ayuno las siguientes pruebas:
Fueron procesadas en su totalidad en CANIA por una misma bioanalista entrenada en el uso de las técnicas e instrumentos, excepto la inmunoglobulina E que se procesó en el laboratorio del hospital José Gregorio Hernández de Caracas.
El hemograma se procesó en un analizador de hematología MD8 Coulter® y el suero para la química sanguínea en un analizador Express Pluss®, de acuerdo a técnicas colorimétricas, para las proteínas, albúmina, calcio, fósforo, hierro, magnesio, glicemia, BUN, creatinina, triglicéridos, colesterol total, colesterol HDL y técnica enzimática estandarizada para la fosfatasa alcalina. El colesterol LDL se estimó por la fórmula de Friedewald (16) y el colesterol VLDL por la razón triglicéridos/5. La determinación de prealbúmina, transferrina, orosomucoide (ácido a 1-glicoproteína), C3, C4 e inmunoglobulinas se realizó por turbimetría (Turbox Orion Diagnostic Finlandia) Ò a diluciones entre 1:10 a 1:50. Los electrolitos se determinaron por el método de electrodos 644 Chiron DiagnosticÒ y el índice creatinina/talla de acuerdo con el método de Viteri (16).
Las heces se analizaron en fresco en busca de parásitos con un microscopio binocular NikonÒ con el objetivo 10x y 40x. En algunos casos se realizaron pruebas de concentración por el método formol-tritón-éter. Las características químicas de la orina se obtuvieron por medio de cintas reactivas MultistixÒ (Bayer) y la observación del sedimento urinario bajo microscopio binocular NikonÒ con el objetivo 10x y 40x.
Durante el período de procesamiento de las pruebas, se realizó diariamente el control de calidad con los patrones de valores conocidos en los diferentes analizadores.
Se validó la transcripción de los datos de este trabajo, mediante una distribución de frecuencia según edad y sexo, determinando los valores mínimos y máximos de cada variable. Los valores extremos se verificaron con los datos de las historias de cada niño; se descartaron aquellos datos fuera del rango fisiológico.
Los niños se agruparon por grupos de edad (? 2 años, 2-6 años, 7-11 años) para cada sexo y se calcularon los estadísticos descriptivos para cada una de las variables cuantitativas y análisis de frecuencia para las variables cualitativas. A través de la prueba de "t" de Student se analizaron las diferencias de los promedios entre los sexos en cada grupo de edad, nivel de significancia 0,05.
Para la categorización de las variables de cada niño (resultado normal o fuera del rango de normalidad) se compararon con tablas de distribución percentilar o con valores de referencia de rangos de normalidad de acuerdo con la edad y el sexo.
Se utilizaron las tablas del U. S NHANES II (NHAHES III para los menores de 3 años) (17) para la hemoglobina, el VCM y el porcentaje de saturación de la transferrina utilizando como punto de corte de normalidad el percentil 5 y para el hematocrito la media – 2 DE; para el perfil lipídico las tablas del National Cholesterol Education Program (17) y como puntos de cortes de normalidad los percentiles 5 y 95.
Se utilizaron los rangos de normalidad referidos en The Hospital for Sick Children Toronto Canadá (18) para las siguientes pruebas: HCM (normalidad > 24 pg), CHCM (normalidad > 32 g/L), leucocitos y su diferencial, plaquetas (150.000-400.000), fósforo (normalidad = 4,0 mg/dL para menores de 1 año, = 3,6 mg/dL entre 1 a 8 años y = de 3,3 mg/dL entre 9 a 10 años), fosfatasa alcalina (normalidad en niños: = 555 UI para menores de 1 año, = de 520 UI entre 1 a 2 años, = de 425 UI entre 3 y 8 años y = de 500 UI entre 9 y 10 años; en niñas: = de 600 UI para menores de 1 año, = de 400 UI entre 2 a 8 años y = de 475 entre 9 a 10 años), magnesio (normalidad = 1,4 mg/dL), BUN (5 – 20 mg/dL), glicemia (normalidad = 45 mg/dL en menores de 4 años, = 50 mg/dL entre 4 a 10 años), C3 (normalidad = 0,6 g /L menores de 1 año y = 0,8 g/L entre 1 a 10 años) y C4 (normalidad = 0,07 g/L hasta 6 meses de edad y = 0,10 para mayores de 6 meses de edad). El total de linfocitos de acuerdo con los puntos de corte, déficit leve 2000 – 1500, déficit moderado 1500 – 900 y déficit grave < 900 (16). Proteínas totales (normalidad > 6 g/dL) y hierro (normalidad > 30 m g/dL en menores 2 años, > 40 m g/dL entre 2 a 5 años y > de 50 m g/dL entre 6 a 12 años) de acuerdo a Gibson (16). Albúmina (normalidad > 3,5 g/dL), prealbúmina (normalidad = 20 mg/dL) y transferrina (normalidad = 200 mg/dL) de acuerdo a Sauberlich (3). Creatinina (0,2 – 0,4 mg/dL) y electrolitos según Oski (19). Calcio (normalidad = 7,9 mg/dL menores de 1 año, = de 8,7 mg/dL entre 1 a 3 años, = de 8,8 mg/dL 4 a 10 años) e inmunoglobulinas A, G y M para cada grupo de edad y sexo de acuerdo con American Association for Clinical Chemistry (20). Orosomucoide, de acuerdo con lo referido por Orion Diagnostic® (0,3-1,3 g/L) e Inmunoglobulina E (< 378 U/ml) de acuerdo con lo normalizado por el instrumento donde se realizó la prueba.
Los rangos para la clasificación del índice creatinina /talla fue la siguiente: sin déficit = 80%, déficit leve entre = 60 - < 80%, déficit moderado entre = 40 - < 60% y déficit grave < 40% (16).
Para cada variable se estimó la proporción de niños y niñas que estaban por debajo o por arriba del límite de normalidad. La significancia estadística de estas dos proporciones se realizó mediante una prueba de Chi- Cuadrado, bajo la hipótesis nula de que para esa variable específica estudiada las dos proporciones son iguales; nivel de significancia 0,05.
Al comparar las concentraciones promedio de cada variable cuantitativa para cada uno de los sexos y grupos de edad, no se encontró diferencia significativa para la Hb, HTC, VCM, HCM, CHCM, plaquetas, leucocitos, proteínas totales, albúmina, prealbúmina, transferrina, orosomucoide, creatinina/talla, hierro sérico, porcentaje de saturación de transferrina, calcio, fósforo, fosfatasa alcalina, magnesio, creatinina, nitrógeno ureico, sodio, cloro, potasio, glicemia, triglicéridos, colesterol total, colesterol de las HDL, VLDL, LDL, inmunoglobulinas A, G, M y E, complemento C3 y C4 excepto que las niñas presentaron concentraciones más altas en las proteínas totales en el grupo 7 – 10 años (p< 0,025), en hierro en el grupo de 7 – 10 años (p< 0,025) y en la Inmunoglobulina A en el grupo de 0 a 11 meses (p< 0,05).
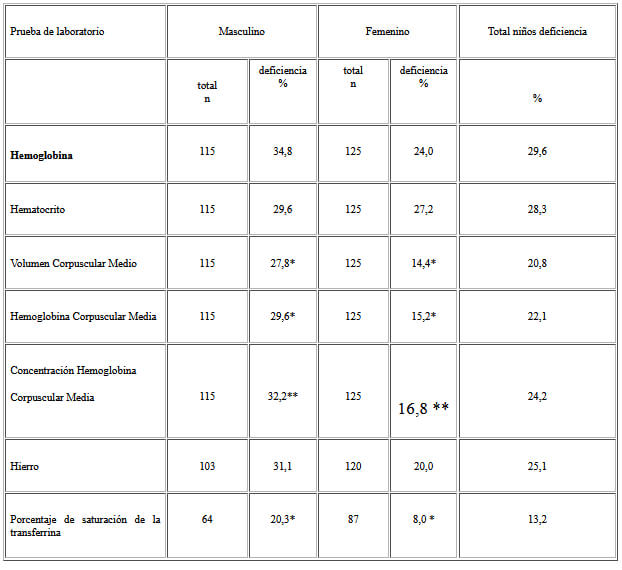
En el Cuadro 1 se presenta la frecuencia de los niños que presentaron las pruebas del hemograma por debajo del límite inferior de la normalidad. En los niños se encontró significativamente una mayor proporción de microcitosis e hipocromía que en las niñas, al igual que una mayor proporción de niños con deficiencia en el porcentaje de saturación de la transferrina. Del total de niños estudiados sólo 3 niños presentaron macrocitosis.
De 71 niños anémicos, 53,5% (n=38) tuvieron microcitosis, 43,7% (n=31) normocitosis y 2,8% (n=2) macrocitosis.
Del total de pacientes anémicos, 62,5% (n=40/64) presentó deficiencia de hierro sérico y 35,9% (n=14/39) porcentaje de saturación de transferrina bajo. Sólo 4 de los niños que presentaron déficit de hierro, tuvieron también déficit de transferrina.

En la Figura 1 se observa la distribución de las concentraciones promedios +/ - error estándar de la Hb. Se puede observar que la concentración promedio de Hb en los niños menores de 2 años de edad tiende a valores deficientes.
Ninguno de los niños tuvo linfopenia; 19,2% (n=46) presentaron leucocitosis. La proporción de niños con eosinofilia (> 4%) fue de 39,2 % (n= 42/107) y 38% (46/121) en las niñas.
Solo se encontró un niño con trombocitopenia y 28,7% (n=33) de los niños y 24,8% (n=31) de las niñas con trombocitosis (plaquetas > 450.000). Cuarenta por ciento (n=33) de los pacientes con trombocitosis presentaron leucocitosis; todos los niños con plaquetas > de 600.000 tuvieron leucocitosis.
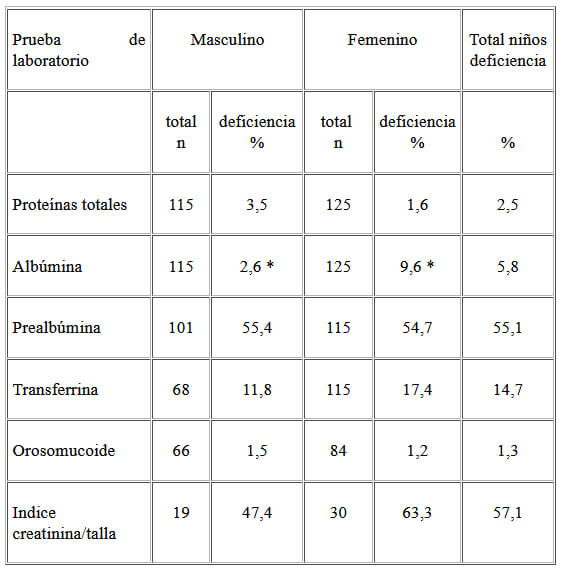
En el Cuadro 2 se presenta la proporción de niños con alteraciones de las proteínas séricas. Solo se encontró diferencia significativa entre los sexos en la albúmina. De los 14 niños que presentaron hipoalbuminemia, 85,7 % (n=12) se encontraron en rangos de depleción de proteína visceral leve (2,8–3,4 g/dL), un paciente en rango de depleción moderada (2,1– 2,7 g/dL) y el restante en rango grave (< 2,1 g/dL). De los pacientes hipoalbuminémicos, 85,7% (n=12) tuvieron anemia, mientras el promedio de la concentración de Hb fue de 9,9 g/dL.
En 22% (n=26) de los niños se observó concentraciones de prealbúmina < 10 mg/dL, rango que se considera depleción de proteína visceral (17).
Cuarenta y tres por ciento (n=21) presentaron índice creatinina /talla en el rango de normalidad, 38,7% (n=19) en rango de déficit leve, 8,2% (n=4) en déficit moderado y 10,2% (n=5) en déficit grave. El orosomucoide estuvo elevado en 10 % (n=15) de los niños.
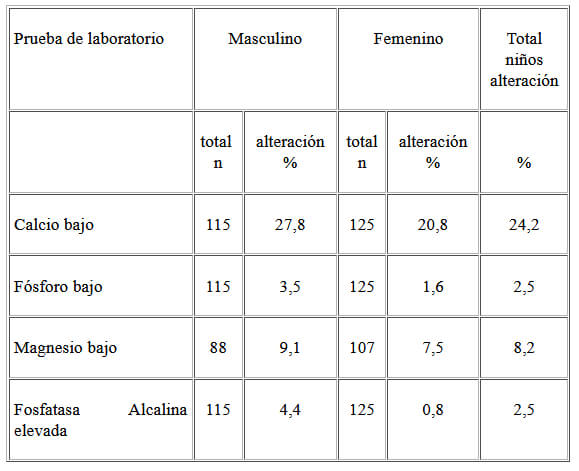
En el Cuadro 3 se señala la proporción de niños con alteraciones en el calcio, fósforo, magnesio y fosfatasa alcalina; no se encontró diferencias significativas en la proporción de alteraciones entre los sexos.
Ninguno de los niños tuvo déficit en los valores de electrolitos séricos. Sólo 2 niños (uno de cada sexo) presentaron valores bajos de creatinina sérica y 28,5% (n=69) valores bajos de nitrógeno de urea (BUN) correspondiente a 43 niñas (34,4%) y 26 niños (22,6%), sin diferencia significativa entre los sexos.
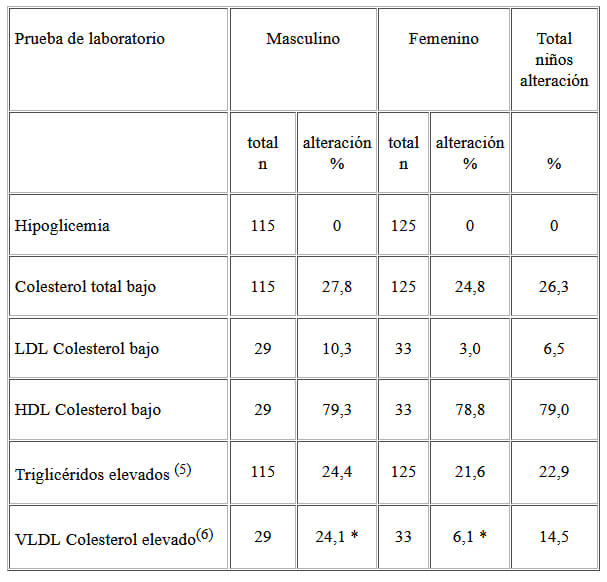
En el Cuadro 4 se presenta la proporción de niños con alteraciones en el perfil lipídico. Solo se encontró diferencia significativa entre los sexos en la elevación del colesterol de las VLDL.
En cuanto a los resultados del complemento, se encontró un 10% (n=14) de los niños con C3 bajo sin diferencia estadísticamente significativa entre los sexos, y sólo 1 niño con C4 bajo.
Se presentaron 13,9% (n=18) de niños con Ig A elevada, 13,1% (n=21) con Ig M elevada, 16,7% (n=27) con Ig G elevada y 2,8% con Ig E por arriba del límite superior de la normalidad. Por el contrario, se obtuvo 4,3% (n=7) de niños con Ig G baja, ninguno con Ig M baja y sólo 1 niño con lg A baja.
Noventa y cinco por ciento del total de niños presentaron resultados normales en el uroanálisis.
En cuanto a la presencia de parásitos en las heces, de 101 niños con exámenes de heces 44 (43,6%) estaban parasitados y de 104 niñas, 46 (44,2%) también presentaron parasitosis intestinal. Los parásitos de mayor frecuencia en ambos sexos fueron Giardia lamblia, seguida de Blastocystis hominis, Ascaris lumbricoides, Chilomastix mesnili; menos del 1% de la población con Trichuris trichiura y Entamoeba histolítica.
En general los resultados de laboratorio en este grupo de edad no difirieron entre las niñas y los niños. En la literatura revisada no se encontró estudios que reporten diferencias de resultados entre ambos sexos.
Al evaluar los resultados del hemograma, se encontró que la anemia fue más importante en los lactantes lo que coincide con lo reportado en otros trabajos realizados en el ámbito nacional en niños desnutridos y eutróficos (21,22). En casi la misma proporción de niños anémicos, se encontró los indicadores que señalan microcitosis e hipocromía los cuales sugieren en primera instancia déficit de hierro como causal principal de la anemia. A esto se le suma la determinación de la concentración de hierro sérico y el porcentaje de saturación de transferrina, que orientan a señalar que la anemia presentada por los niños pudo ser debida a una ingesta deficiente de este mineral en la mitad de los niños anémicos, principalmente en los lactantes, aunque por no contar con ferritina no se pudo conocer el estado de los depósitos corporales del hierro.
Los varones tuvieron mayores alteraciones que las hembras en las pruebas del hemograma, alguna de ellas de forma significativas como aquellas que identifican morfología eritrocitaria. Desconocemos las causas de este hallazgo, muy probablemente pudieran ser atribuidas a deficiencias en la ingesta de nutrientes específicos como es común en la desnutrición.
Muy pocos niños presentaron anemia con macrocitosis que pudiera orientar a déficit de folato o B12; el resto de los niños anémicos presentó morfología eritrocitaria normal que se ha descrito en personas desnutridas dentro de un estado de deficiencia calórico proteica.
Es frecuente encontrar en los niños desnutridos procesos infecciosos de cualquier etiología. Los resultados de la trombocitosis, leucocitosis y el porcentaje de niños con orosomucoide elevado (proteína reactante aguda) señalan que menos de un 1/3 de los niños tuvo o tenía algún proceso agudo infeccioso o inflamatorio que se debe tomar en cuenta para la evaluación de otras pruebas de laboratorio como las proteínas.
La eosinofilia está relacionada con la respuesta específica de las células T a ciertos antígenos en enfermedades alérgicas (rinitis, asma o reacciones a drogas) o alergenos parasitarios en infecciones por parásitos intestinales: Ascaris, Anquilostoma, Necator, Filarias, Estrongiloides, Toxocaras, la cual es la principal causa de eosinofilia en países no desarrollados (23). Los parásitos intestinales identificados en estos pacientes fueron protozoarios en su mayor proporción, los cuales no han sido vinculados como causal de eosinofilia, aunque 4 niños se identificaron con toxocariasis y 17 con ascaridiasis. Diez niños presentaron asma y 19 procesos inflamatorios agudos y crónicos del sistema respiratorio superior. En el resto se desconoce la posible causa de la eosinofilia.
Los resultados de las proteínas séricas de estos niños señalan que no hubo deficiencia importante en las proteínas totales, la albúmina y la transferrina como lo han reportado también otros estudios, ya que las proteínas de transporte no tienen una relación constante con la cantidad total de proteína corporal, por lo tanto no son indicadores sensibles del estado proteico visceral, ni de grados leves de desnutrición aguda (3,16,24-27) por su larga vida media; su verdadera utilidad es para diagnosticar la severidad de la desnutrición y para pronóstico (24).
Si se encuentran valores bajos de una de estas proteínas, indica deficiencia de éstas en la dieta (5) o pérdidas aumentadas. Los niños que presentaron resultados fuera de los rangos considerados normales, posiblemente tuvieron un subconsumo proteico, porque ninguno tuvo indicios de enfermedad asociada a la desnutrición perdedora de proteína.
Hassanein y col (11) demostraron que las proteínas totales y la albúmina en niños desnutridos leves, no fueron indicadores sensibles de la deficiencia nutricional, debido a la larga vida media de estas proteínas (20 días), 60% a 70% es extravascular y el pool que el individuo presenta es grande (50% - 60% del total de proteínas), que hace que pueda mantener síntesis hepática, reducir catabolismo en presencia de deficiencia proteica e inclusive redistribuirse desde el tejido intersticial al vascular, sin que ocurran cambios a nivel sanguíneo (25,26). Los resultados de este trabajo coinciden con lo expuesto por otros autores acerca de que estas proteínas no aportan más datos al diagnóstico de la desnutrición moderada porque se encuentran normales, sin embargo, tradicionalmente la albúmina ha sido considerada una medida del estado nutricional y es un método fácil de realizar y disponible en la mayoría de los hospitales (3,16,24).
En los casos en que se observe hipoalbuminemia, deben encontrarse también otras alteraciones como la anemia, las cuales son signos de mal pronóstico y de gravedad (5).
El índice creatinina/talla al igual que la prealbúmina fueron las pruebas que presentaron la mayor proporción de niños con resultados fuera del rango de normalidad.
Ingenbleek y col en un estudio llevado a cabo en Senegal, concluyeron que la prealbúmina comparada con la transferrina y la albúmina, fue un indicador adecuado y el más útil para definir el estado nutricional porque la prealbúmina fue la primera proteína en sangre en estar significativamente disminuida, como resultado de la ingesta proteica baja en niños (27); pero también la restricción de energía tiene un efecto más profundo en las proteínas de intercambio rápido, que el déficit de proteína en la dieta (26). La prealbúmina sérica tiene una vida media de 2 a 3 días (3,16) y disminuye en 3 a 4 días cuando la ingesta calórica-proteica es más baja de lo requerido (3,25), de ahí su importancia en la desnutrición de menor intensidad (12,28). La prealbúmina en ciertos aspectos puede ser mejor indicador de ingesta dietética reciente, que un indicador preciso que estima el estado nutricional porque el aumento energético produce rápida normalización de esta proteína (3).
El índice creatinina/talla es un indicador bioquímico de composición corporal, se utiliza para conocer el grado de agotamiento de los depósitos o de recuperación de la masa muscular (reserva proteica) en pacientes marasmáticos, ya que se ha comprobado que la excreción de creatinina urinaria está correlacionada con la masa muscular (4,29).
De igual manera es útil en la detección de desnutrición marginal o subclínica (3). Hay que interpretarlo con cautela por su alta variabilidad en sujetos sanos y porque no todo desnutrido tiene un índice bajo (29). En un estudio en niños sanos guatemaltecos, la media fue de 96 %, pero 26% presentaron rangos de déficit, así que se sobrepusieron rangos normales con deficitarios (30), lo que redujo la sensibilidad de la prueba. En cambio en este estudio la media de las concentraciones fueron 69% y la proporción de deficiencia de 57% del total de niños.
Una cuarta parte de los pacientes presentó hipocalcemia, pero la proporción de niños con fósforo y magnesio fuera del rango de normalidad fue baja. El hecho de que los niños estén desnutridos los hace susceptibles a que la ingesta del mineral no haya sido la más adecuada para mantener niveles normales en sangre.
Hasta el momento no hay un indicador bioquímico que refleje el estado nutricional del calcio; investigaciones recientes sugieren que el marcador bioquímico de los cambios en el tejido óseo (recambio óseo), medido por la tasa de formación y reabsorción ósea, predice los cambios en la masa ósea y el riesgo de fractura (30).
Cuando los niveles de fósforo están disminuidos, hay disfunción celular y esto es importante tenerlo en cuenta en el desnutrido. El US Food and Nutritional Board señaló que el indicador que debe ser utilizado en la adecuación nutricional de la ingesta de fósforo, es el fósforo sérico en pacientes adultos. En niños es difícil definir el valor crítico de ingesta de fósforo asociado con rangos normales de fósforo sérico; las estimaciones de los requerimientos de fósforo son factoriales de los datos de adultos (30).
La medida del magnesio (Mg) sérico puede no reflejar el verdadero contenido del Mg corporal total y se han documentado pacientes con Mg intracelular bajo, con niveles séricos por encima del límite inferior de la normalidad (30). El estudio de este mineral debe completarse con la evaluación dietética de la ingesta para poder llegar a conclusiones.
La glicemia y los electrolitos son indicadores que responden rápidamente a cambios inmediatos en la ingesta de ellos, y se normalizan en sangre en la fase de compensación de una desnutrición grave, que no es el caso de los niños de este estudio con menor grado de desnutrición, por eso no hubo deficiencias, así que estas pruebas tampoco aportan mayores datos al diagnóstico.
En la desnutrición se observa disminución de las concentraciones del colesterol total y de la fracción HDL. Los triglicéridos se pueden encontrar en valores bajos, normales o altos (5,8,9).
Muchos trabajos han reportado que mientras mayor es el grado de severidad de la desnutrición, mayor es la concentración de triglicéridos y de colesterol de las VLDL en plasma (8). Por el contrario, las concentraciones de colesterol total, colesterol de las LDL y HDL en plasma disminuyen a medida que aumenta la gravedad de la desnutrición (8,9). Los hallazgos de este estudio en el perfil lipídico coinciden con lo que reporta la literatura en niños desnutridos, más sin embargo, estos resultados no aportan más datos que cambien el tratamiento nutricional indicado para niños con desnutrición moderada.
En trabajos con niños con desnutrición moderada no se ha observado niveles bajos de C3 (6), como se ha reportado en niños gravemente desnutridos con además C4 aumentado o normal (6,7,31-33). Sin embargo, en este trabajo se encontró déficit de C3 en una proporción pequeña y en casi los mismos rangos del déficit de transferrina y algo mayor que el de la albúmina. Los niveles de C4 fueron normales en casi la totalidad de los pacientes.
La reducción del C3 en la desnutrición se ha interpretado como que es debida a un factor sérico anticomplementario, por aumento del catabolismo o disminución de la síntesis hepática. No se ha correlacionado con indicadores bioquímicos de infección, así que los cambios en el C3 en desnutridos graves se deben a cambios en el metabolismo proteico (6), debido a que se correlaciona fuertemente con parámetros bioquímicos como las proteínas séricas (6,32).
En desnutridos graves se encuentran niveles normales, bajos y hasta altos de inmunoglobulinas (6,7), secundaria a infecciones repetidas, no así la Ig A secretora que siempre se encuentra bajo la norma (6,32). En este trabajo los resultados de las inmunoglobulinas séricas estuvieron en rangos de normalidad para la casi totalidad de los pacientes, por lo que no se justifica su indicación en estos pacientes.
Los parásitos intestinales encontrados en este trabajo fueron en su mayoría del grupo de los protozoarios; igual hallazgo se ha encontrado en el resto de la población que es atendida en este Centro. En un estudio realizado en Caracas en 126 niños, se reportó que 55,6% presentó parasitosis intestinal y el más común fue el Ascaris lumbricoides (34). El Proyecto Venezuela (21) encontró que en el estrato IV y V del Graffar modificado el porcentaje de parasitosis intestinal fue de 6,9% a 43% en todo el país, en cambio en el estrato I y II fue menor del 6%. Las condiciones higiénicas – sanitarias de los estratos más bajos no son por lo general las más adecuadas, y es común la relación desnutrición y parasitosis.
De acuerdo con los resultados de este trabajo el perfil de laboratorio de niños con desnutrición moderada, solo debería incluir: hemograma, porcentaje de saturación de transferrina y ferritina; prealbúmina, C3 e índice creatinina/talla para estudiar el estado proteico; calcio, fósforo y fosfatasa alcalina para identificar el grado de raquitismo subclínico; magnesio, coproanálisis y uroanálisis especialmente en niños pequeños, ya que es una forma sencilla de descartar infección urinaria y alguna alteración en el funcionalismo renal.
Un detalle que generalmente no se toma en cuenta es el balance entre el costo de las pruebas de laboratorio y la efectividad de estas pruebas en aportar elementos que ayuden a concretar el diagnóstico o a orientar el tratamiento. El costo de todas las pruebas evaluadas en este trabajo por cada niño para 2001 está alrededor de 99.000,00 bolívares (150 $). El resto de las pruebas analizadas no serían necesarias realizarlas, porque no aportan datos que hagan cambiar el diagnóstico o el tratamiento nutricional, a menos que se sospeche por la clínica, alguna alteración que justifique su realización, disminuyendo así el monto inicial en 54.200 bolívares (82,10 $).
Recibido: 23-03-2001
Aceptado: 24-06-2001