La capacidad funcional del sistema inmune declina gradualmente con la edad. Los linfocitos T son más severamente afectados que los linfocitos B. Esto último se debe principalmente a la involución del timo la cual se completa alrededor de los 60 años de edad. Mas que con una disminución del recuento total de linfocitos, el envejecimiento se asocia con cambios en el equilibrio de las subpoblaciones linfocitarias; así se eleva el número de células T CD2+CD3- inmaduras, de células T de memoria (CD45RO), de células T ayudadoras TH2 y de linfocitos B CD5+. La nutrición tiene una fuerte influencia sobre el sistema inmune del anciano. Las deficiencias nutricionales ejercen efectos acumulativos sobre la inmunosenescencia. La suplementación de nutrientes puede restaurar o prevenir la declinación de la respuesta inmune en los ancianos. Se revisan interacciones entre la inmunidad, el envejecimiento y el estado nutricional.
Palabras clave: Envejecimiento, sistema inmune, nutrición, zinc, inmunidad celular, inmunidad humoral.
Functional capacity of immune system decline gradually with age. T-lymphocytes cells are affected more profoundly than B-lymphocytes. This difference is mainly attributed to thymic involution that reaches maximum after 60 years of age. Aging is associated to changes in the equilibrium of lymphocyte subpopulations, like an increase of immature CD2+CD3-T cells, memory T-cells (CD45RO), helper TH2 T-cells and CD5+ B-cells; more than to a decrease in total count of lymphocytes. Nutrition have a very strong influence on immune system and its response in elderly people. Nutritional deficiencies exert accumulative effects on immune senescence. In elderly persons, nutritional supplementation can restore or prevent the decline of immune response. Interactions between immunity, aging and nutritional status are reviewed.
Key words: Aging, immune system, nutrition, zinc, cellular immunity, humoral immunity.
La respuesta inmune es una de las funciones corporales que más profundamente se ve afectada por el envejecimiento. Con la edad, ocurren cambios dentro del sistema inmune que provocan una pérdida de la eficiencia de los mecanismos de defensa. La inmunogerontología, o el estudio del sistema inmune del anciano, es un área del conocimiento relativamente nueva que, no obstante, actualmente contribuye más a la compresión del proceso de envejecimiento como un todo. La nutrición es un determinante critico de la inmunocompetencia. Los ancianos frecuentemente sufren deficiencias nutricionales, de tal manera que su sistema inmune se enfrenta tanto a la senescencia como al efecto deletéreo de tales déficits. El propósito de la presente revisión será discutir los distintos cambios que sufre el sistema inmune con el envejecimiento, así como, describir la influencia de la nutrición dentro de la respuesta inmune de los individuos de edad avanzada. Dado el amplio número de nutrientes que intervienen en la función inmune, la revisión se restringe a los nutrientes de mayor importancia y/o que a menudo se encuentran deficitarios en los ancianos.
El número de linfocitos en sangre periférica usualmente decrece con la edad. En las personas ancianas sanas, esta declinación representa solamente el 10 al 15 % de los conteos linfocitarios (1). En contraste con los pequeños cambios que sufre el recuento linfocitario total, existen importantes modificaciones del equilibrio entre las subpoblaciones de linfocitos T en sangre periférica. Los ancianos tienen menos linfocitos T CD3+ maduros y más células T CD2+CD3- inmaduras que los individuos jóvenes. La disminución de la población de células T CD3+ maduras está asociada con un descenso de la subpoblación de linfocitos T CD8+ ó linfocitos T supresores/citotóxicos, mientras que la subpoblación de linfocitos T CD4+ ó linfocitos T ayudadores se mantiene con pocos cambios en términos de número absoluto, produciéndose así un incremento de la razón CD4+:CD8+ (2, 3).
Considerando que las subpoblaciones linfocitarias son susceptibles a cambios en respuesta a enfermedades coexistentes, algunos de los datos publicados sobre dichas subpoblaciones en ancianos podrían no ser los más exactos. Así el estudio de SENIEUR, que se basó no sólo en criterios de salud subjetivos (ausencia en el anciano de enfermedades agudas y de aquellas que puedan influir la respuesta inmune) para la admisión de los sujetos sino también en la normalidad absoluta en un amplio rango de pruebas de laboratorio, no encontró diferencias en el número de linfocitos T CD3+ o CD4+ circulantes y únicamente observó una declinación ligera en los linfocitos T CD8+ (4). Por el contrario, entre ancianos con neumonía es mucho más frecuente que en los pacientes jóvenes la linfopenia, la cual está relacionada con una reducción de las células T CD4 (3).
Los cambios también se reflejan en las células T vírgenes (CD45RA) y las células T de memoria (CD45RO). Las células T vírgenes son células T inactivas que nunca han sido expuestas a algún antígeno extraño, mientras que las células T de memoria son células activadas por antígenos, de larga vida y que rápidamente responden a una segunda exposición al mismo antígeno. Al enfrentar un antígeno extraño, las células T vírgenes se activan, estimulan al sistema inmune para eliminar el antígeno extraño del cuerpo y se convierten en células T de memoria. En el anciano se advierte un incremento de las células CD45RO de memoria y una disminución paralela de las células CD45RA vírgenes debido a que el timo progresivamente se deteriora con la edad, así muy pocas células T son producidas y la subpoblación de células T vírgenes no es repuesta (1-8), además de ello el timo envejecido favorece el mantenimiento de las células T de memoria más que de las células T vírgenes (9). El conteo de células T vírgenes (tanto CD4+ como CD8+) disminuye con la edad, sin embargo, al parecer la población de células T CD8+ vírgenes resulta más alterada pues sufre una depleción casi completa en los individuos más ancianos (centenarios) (8). Como consecuencia de estos cambios las células T vírgenes se depletan y el sistema inmune envejecido no puede responder tan apropiadamente como lo haría una persona joven frente a un "nuevo" antígeno (7).
Una de las principales razones de que las células T sean tan susceptibles al envejecimiento se encuentra en el hecho de que el reclutamiento de las células T en el timo ocurre exclusivamente en la etapa de recién nacido y ese reclutamiento es muy pequeño en la adultez debido al proceso denominado "involución tímica", y a ello se le ha atribuido la responsabilidad por la inmunosenescencia ya que el timo es el órgano donde maduran tales células. Poco después de alcanzar la masa celular máxima y alrededor de la pubertad (al obtenerse la madurez sexual), el timo comienza a involucionar tanto en humanos como en ratones (10), hasta completarse dicha involución entre la quinta y sexta década de la vida (11). El volumen del tejido tímico en un adulto de 60 años de edad es menos del 5% del volumen que presentaba al momento del nacimiento (7).
No se conoce por qué el timo involuciona. La teoría que prevalece es que el timo es un órgano extremadamente costoso en términos de energía que se necesita mayormente en las etapas tempranas de la vida cuando el organismo no ha tenido oportunidad de desarrollar resistencia a antígenos extraños. Una vez que el sistema inmune se desarrolla completamente y puede proteger al huésped, el timo puede ser muy costoso para mantenerlo, y sería una ventaja evolutiva disminuir la cantidad de tejido tímico y usar la energía que lo mantenía en otros propósitos (7). Existen otros tres posibles mecanismos: 1) Agotamiento clonal, es decir, las células tímicas podrían estar genéticamente programadas para autodestruirse y morir después de sufrir un número fijo de divisiones; 2) Alteración del ADN de las células tímicas al azar o por infecciones virales, desorganizándose el mecanismo de auto-tolerancia; 3) Alteración molecular estable no ubicada a nivel del ADN (12).
La declinación de la actividad endocrina tímica asociada a la edad parece ser la principal causa del deterioro observado en la vejez del compartimento de células T periféricas, de la eficiencia de las células T con propiedades citotóxicas y de las células con actividad ayudadora y supresora. Las células epiteliales tímicas sintetizan las hormonas tímicas, tales como: el factor humoral tímico, la timopoyetina, la timosina a 1 y la timulina. La timulina, declina progresivamente desde el nacimiento hasta la vejez y es virtualmente indetectable en humanos después de los 60 años de edad, aunque recientemente se ha comprobado que la declinación de esta hormona es menos pronunciada de lo que previamente se había reportado, incluso en edades muy avanzadas se puede detectar una producción residual de timulina (11).
El envejecimiento no sólo trae defectos cuantitativos en los linfocitos T sino también alteraciones funcionales. La proliferación linfocitaria disminuye con la edad debido al incremento de las células T inmaduras así como también por los cambios en la relación células T vírgenes/células T de memoria y a que tanto las células T inmaduras como las de memoria secretan en menor cantidad interleuquinas como la interleuquina-2 (IL-2) (3). Así las reacciones cutáneas de hipersensibilidad retardada con antígenos comunes (ej. Cándida albicans y PPD) son menos enérgicas y menos frecuentes con los antígenos contra los cuales los ancianos presumiblemente se han expuesto anteriormente. También se observa disminución del rechazo a injertos (3,4,13- 16).
Los estudios in vitro, que se basan fundamentalmente en la respuesta de los linfocitos a distintos mitógenos o a antígenos in vitro, en general, han demostrado que la capacidad de las células linfoides para responder a un estímulo mitogénico, como la fitohemaglutinina (PHA) o la concanavalina A (Con A), desciende con la edad (3,4,14). Estos mitógenos parecen fijarse normalmente a los receptores celulares, los que en apariencia se encuentran presentes en cantidades normales, sin embargo, en los ancianos pareciera que la cantidad de células capaces de responder al estímulo y de ingresar al ciclo celular es la mitad de la observada en los jóvenes (14) y en particular los linfocitos sufren menos ciclos después de la estimulación (17).
Muchos de los eventos que están relacionados con cada una de las fases del ciclo celular linfocitario muestran alteraciones con el envejecimiento; así se han identificado problemas a nivel de la composición y viscosidad de la membrana plasmática, movilización de calcio, hidrólisis del fosfatidilinositol, activación de la proteinquinasa, y capacidad para generar la energía metabólica (10,17). Una deficiencia de calcio en los linfocitos T efectivamente detiene la transducción de señal y puede inhibir la producción de citoquinas, que son las proteínas responsables de coordinar la interacción con el antígeno y de la amplificación de la respuesta inmune (7). Las células T envejecidas no expresan sobre su superficie el marcador CD28, una molécula crítica para la transducción de señal y para la activación de la célula (7,18). Sin dicha proteína, las células T permanecen inactivas y no responden a los patógenos extraños. Otra indicación del malfuncionamiento del proceso de transducción de señal en las células T de los ancianos es la baja presencia del marcador CD69 sobre la superficie celular ya que el mismo se expresa solamente después que el antígeno se une al receptor de la célula T (7).
En las últimas etapas del ciclo celular (transición desde G1a a G1b) se han reportado alteraciones en la síntesis de IL-2 y en la expresión de receptores para IL-2. La función de la célula T se deteriora fuertemente si la IL-2 no es producida en suficiente cantidad o si las células T no pueden responder efectivamente a la dicha interleuquina, ya que la misma representa una segunda señal necesaria para conducir a la célula hacia la síntesis de ADN y, por ende, a la proliferación efectiva (3,4,7,17). El defecto relacionado a la IL-2 parece complejo. Tanto la producción de esta interleuquina por las células T en reposo estimuladas (predominantemente células ayudadoras CD4+) como la respuesta de las células T proliferantes activadas a una cantidad dada de IL-2 producida están reducidas en los seres humanos que envejecen. La investigación sugiere que el defecto de producción de IL-2 reside en una incapacidad de los linfocitos para expresar el ARN mensajero de dicha interleuquina, mientras que el defecto de respuesta puede relacionarse, en parte, en la incapacidad de los linfocitos del anciano para expresar el receptor de IL-2 o antígeno Tac (especialmente el de alta afinidad), el cual es expresado durante la porción tardía de G1a a G1b en el ciclo celular (3,4,7,14,17,19,20). La reposición in vitro de hormonas tímicas (ej. timosina, timopectina), ha logrado aumentar la producción de IL-2 en la respuesta proliferativa (14) mientras que la adición in vitro de IL-2 restaura la proliferación de las células T vírgenes envejecidas y repone la eficiencia de generación de células efectoras que, además, son indistinguibles de aquellas derivadas a partir de células CD4 jóvenes (21).
No sólo la producción de IL-2 se encuentra alterada durante el envejecimiento. Los cambios en la secreción de otras interleuquinas están asociados a la modificación de la relación entre subpoblaciones de linfocitos T ayudadores. Las células T ayudadoras se subdividen en células TH1 (favorecen la expansión de las células T efectoras CD8+ y la activación de macrófagos) y células TH2 (sostienen la producción de anticuerpos). En comparación con el individuo joven, en el anciano existen más células ayudadoras TH2 y menos células ayudadoras TH1 (3,4). La alteración de la relación TH1/TH2 probablemente se deba a la exposición antigénica acumulativa a través de toda la vida, y da fundamento o apoyo a las observaciones de que durante el envejecimiento la secreción de algunas interleuquinas disminuye pero aumenta la de otras y, de que las células T citotóxicas decrecen mientras que los linfocitos B se mantienen con el avance de la edad. Todas las citoquinas que se incrementan con la edad (IL-3, IL-14, IL-6, IL-10) son sintetizadas por las células T TH2, mientras que aquellas que son dependientes de las células T TH1 están disminuidas, tal como sucede con la IL-2, o permanecen a niveles normales como ocurre con el interferon g (IFN-g ) que en cuyo caso también es producido por las células T memoria (3,4,6,20,22).
Por último, y no por ello menos importantes, se cuentan alteraciones a nivel nuclear en los linfocitos T al transcurrir los años. Entre estas se incluyen (a) pérdida de cromosomas; (b) reducción de la región nuclear (descenso del contenido de ADN ribosomal y/o de la actividad transcripcional del ADN ribosomal); y (c) incremento de la frecuencia de células T con micronúcleos, lo cual puede contribuir a la incapacidad de las células T de los individuos ancianos para proliferar extensamente en respuesta a la estimulación antigénica o mitogénica (10). También se han detectado diversos cambios funcionales en el núcleo de las células T envejecidas, entre estos se tienen: (a) disminución en la capacidad para reparar los daños inducidos por la luz ultravioleta; (b) disminución en el nivel de la polimerasa del ADN de bajo peso molecular; (c) disminución en la actividad de la purín-nucleótido-fosforilasa, cuya ausencia puede causar incremento en el nivel del desoxiribonucleósido tóxico (10); y (d) alteraciones que elevan la susceptibilidad a la apoptosis tales como: deterioro o inactivación de factores de transcripción del ADN (como Nf-kB y AP-1) con fallas en la activación de los genes necesarios para la estimulación de la célula T, pérdida gradual de los telómeros que cubren los extremos de los cromosomas para prevenir la degradación del ADN, problemas con el rearreglo del gen del receptor de la célula T (7) e incremento de la expresión de genes que promueven la apoptosis y disminución de la expresión de aquellos que la inhiben (23). La amplificación del proceso apoptótico en los linfocitos senescentes es una de las explicaciones propuestas al aumento de las células T de memoria CD45RO dado que se ha evidenciado una elevación de la apoptosis de las células T CD45RA (24).
Los cambios en las células B con el envejecimiento son mucho más sutiles que los observados en las células T, además en buena parte están relacionados con la disfunción que sufren estas últimas. El número de linfocitos B se modifica muy poco en los ancianos, así mismo, la respuesta proliferativa de estas células a estímulos mitogénicos se mantiene inalterada o marginalmente reducida. La concentración total de inmunoglobulinas en suero no cambia en gran medida con el avance de la edad, no obstante, existen cambios en la proporción relativa de las diferentes clases de inmunoglobulinas. Así, los niveles sanguíneos de IgG y de IgA se encuentran incrementados en los individuos sanos ancianos mientras que los niveles de IgM se presentan medianamente reducidos (3,4,6,14). La calidad de los anticuerpos específicos está afectada ya que tienen más baja afinidad por los antígenos y tienen un espectro más estrecho (3,25,26). Los niveles circulantes de anticuerpos naturales (como las isoaglutininas, anticuerpos contra eritrocitos de carnero y salmonella) en humanos declinan con la edad justo después de que el timo comienza a involucionar y de que el nivel sérico de timosina comienza a declinar (12,14,16).
Las respuestas primarias de anticuerpos en estos individuos están disminuidas, mientras que las respuestas a inmunizaciones de refuerzo son comparables a las observadas en individuos jóvenes. En los ancianos el pico de la respuesta primaria se alcanza en forma retardada, esto se traduce en niveles de anticuerpos más bajos que decrecen mas pronto (1,3). Las personas ancianas no responden de la misma manera como lo hacen los individuos jóvenes a una vacunación; obtener inmunidad en un anciano puede ser una tarea muy difícil (27).
La causa de la menor respuesta de las células B parece residir principalmente en la influencia controladora de otras células, aunque también pueden existir alteraciones intrínsecas en estas células. De hecho, las respuestas de anticuerpos para antígenos timo-dependientes declinan más en comparación a las generadas contra antígenos timo-independientes (ej. lipopolisacárido) (3,13,15). Parte del problema parece residir, entonces, en la deficiencia de las células T ya que estas actúan regulando la producción de anticuerpos. Las células T inducen a las células B para hipermutar los genes de las inmunoglobulinas, lo cual crea la diversidad de anticuerpos necesaria para reconocer un amplio rango de antígenos, así en el envejecimiento el mecanismo de hipermutación de los genes que codifican las inmunoglobulinas parece ser ineficiente (7,26). La disminución de la respuesta también parece ser consecuencia de las respuestas inmunes acumuladas a través de toda la vida, probablemente asociada al incremento de la relación TH2/TH1 (3).
En la inmunidad humoral se observa una de las principales paradojas de las alteraciones en la función inmune durante el envejecimiento; la menor capacidad para elaborar respuestas óptimas de anticuerpos específicos frente a la elevación de la producción de autoanticuerpos y de inmunoglobulinas monoclonales, al parecer no funcionales. En las poblaciones humanas sanas, la prevalencia de proteínas monoclonales aumenta desde menos del 0,1% en las personas menores de 60 años hasta del 10% en las personas de 80 años y del 15 al 20% en los sujetos mayores de 90 años. La mayoría de las personas ancianas con estos hallazgos no presentan síntomas. Con el tiempo, sin embargo, hasta el 25% de estas personas pueden demostrar progresión a un trastorno linfoproliferativo maligno. La explicación a este aumento notable de las proteínas monoclonales como presunta manifestación de disregulación inmune se desconoce; no obstante, puede relacionarse con alguna de las alteraciones comentadas previamente en el control de la función de las células B ejercido por las células T (14).
La incidencia aumentada de autoanticuerpos en las personas ancianas es similar a la demostrada por las proteínas monoclonales. La frecuencia de estos fenómenos, que incluyen elevaciones en los autoanticuerpos contra la tiroglobulina, núcleo o ADN, músculo liso, mitocondria, linfocitos, células gástricas parietales, inmunoglobulinas, etc. (14,16,28) es tal que puede considerarse parte del espectro del proceso normal de envejecimiento. En semejanza a las proteínas monoclonales, la enfermedad autoinmune per se no parece estar aumentada en gran medida en los ancianos, así por ejemplo, la prevalencia de enfermedades autoinmunes tiroideas no aumenta aun cuando los autoanticuerpos tiroideos son uno de los tipos de autoanticuerpos más comunes en la vejez (29).
Se desconocen aun las razones por las cuales la producción de autoanticuerpos en pequeñas cantidades sea una parte normal del envejecimiento. Una posibilidad es que las mutaciones asociadas con la edad en los genes de las células T pueden crear una subpoblación de linfocitos T que reconozcan antígenos del propio huésped. Normalmente, tales células T serían eliminadas en el timo antes de que madurasen completamente, pero la involución tímica permite que esta población destructiva de células T persista. Estas células podrían entonces inducir a las células B para producir autoanticuerpos contra antígenos propios (7). Otra posible interpretación del aumento de los autoanticuerpos es que se producen en un intento por manejar las células seniles dañadas en diversos órganos (14).
El incremento de los autoanticuerpos también se encuentra presumiblemente relacionado con los cambios que las subpoblaciones de células B sufren durante el envejecimiento ya que se observa que el porcentaje de linfocitos B CD5+ (involucrados en la secreción de autoanticuerpos) se eleva mientras que la proporción de linfocitos B CD5- (encargados de sintetizar anticuerpos contra antígenos extraños) se reduce (1,3,4,6,14).
Por otra parte, la modificación con la edad del equilibrio TH1/TH2 favorece la producción de anticuerpos más que la inmunidad celular, y de alguna manera podría contribuir a la aparición de enfermedades. La elevación de la secreción de IL-10 que resulta del aumento de las células TH2 se ha asociado a la producción de autoanticuerpos en los ancianos dado que en enfermedades como el lupus eritematoso y la artritis reumatoidea la presencia de autoanticuerpos depende de la producción endógena de dicha interleuquina; así mismo la IL-6, otra interleuquina que se eleva con el avance de la edad, puede jugar un papel dentro de la autoinmunidad, de la génesis de tumores y/o en la osteoporosis, en la ateroesclerosis, fibrosis y demencia (4,30). Por último de cara a la relación autoanticuerpos-enfermedad, al parecer existe un caso muy especial, la Enfermedad de Alzheimer (EA). La inmunosenescencia puede ser incluida entre los muchos factores biológicos asociados a la declinación neurológica de la vejez, a la EA, o a ambas. Se ha demostrado un progresivo aumento con la edad de la incidencia de "anticuerpos cerebro-reactivos" tanto en humanos como en ratones y primates. Los niveles séricos de estos anticuerpos son significativamente más elevados en las personas con demencia senil y están globalmente relacionados con el grado de deterioro cognitivo; adicionalmente, en la EA tienen como blanco los antígenos de neurofilamentos, neurofibrillas, y componentes de las neuronas colinérgicas (31).
Las deficiencias nutricionales son vistas en al menos un tercio de los ancianos en países industrializados. Indudablemente ciertos individuos ancianos están particularmente en alto riesgo para desarrollar malnutrición: los físicamente aislados; aquellos que viven solos; aquellos que recientemente han enviudado; los aislados socialmente; aquellos con problemas sensoriales o mentales; aquellos con enfermedades crónicas sistémicas; los muy pobres; y los de edad muy avanzada. La situación se agrava por la falta de variedad en las dietas, la presencia de malabsorción en algunos casos, y por las interacciones droga-nutriente (15).
A la inmunosenescencia se suman muchos otros factores que favorecen la susceptibilidad de las personas en edad avanzada, sin embargo, ninguno de ellos de tanta magnitud como el estado nutricional. La simultanea evaluación del estado nutricional y de la respuesta inmune y los análisis de correlación subsecuentes han sugerido que el deterioro de la inmunidad en el anciano puede ser en parte asociado a deficiencias nutricionales. A continuación se revisa la relación entre la función inmune durante el envejecimiento y algunos nutrientes importantes y/o que frecuentemente se encuentran deficitarios en el anciano. Las funciones inmunes deterioradas en relación a los nutrientes tratados se resumen en el Cuadro 1.
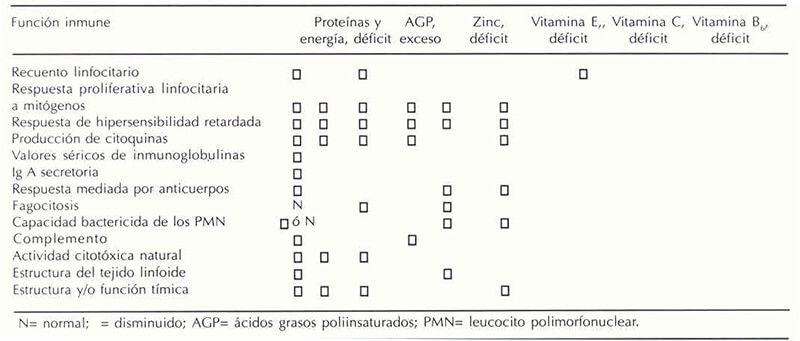
Muchos ancianos consumen dietas bajas en proteínas y se cuestiona aun más la adecuación de las ingestas dietarias proteicas en los países en desarrollo donde se consumen dietas con mezclas de proteínas que contienen entre 0,4 y 0,8 gramos de proteínas/kg de peso corporal/día. Castañeda y sus cols. (32) en un estudio de adaptación a ingestas proteicas marginales en ancianas reportaron que el organismo se adapta a la situación mediante un compromiso funcional que, entre otras cosas, incluye disminución de la respuesta inmune y de la función muscular, demostrándose la importancia de las proteínas dentro de la inmunidad y dentro de unas de las funciones, como lo es la muscular, cuyo deterioro favorece en gran parte la susceptibilidad de los ancianos a los procesos infecciosos dado que contribuye a la inmovilidad parcial o total del anciano.
La restricción dietaria durante la vida puede promover la función inmune y la longevidad (33), no obstante, cualquier deprivación patológica de proteínas y calorías a cualquier edad ocasiona alteraciones severas en la función inmune. Entre las anormalidades que provoca la malnutrición proteico-calórica (MPC) se tienen: atrofia tímica, reducción de la frecuencia y magnitud de las respuestas cutáneas de hipersensibilidad retardada, reducción del número de linfocitos T maduros, disminución de linfocitos T (particularmente células T CD4+) y de la actividad citotóxica natural, descenso de la respuestas linfocitarias frente a mitógenos y células alogénicas, disminución de la actividad del complemento (bajas concentraciones del factor C3 y del factor B), deterioro de la respuesta mediada por anticuerpos ante antígenos que requieren de la cooperación de los linfocitos T ayudadores, disminución de la IgA secretora, pérdida de afinidad de los anticuerpos, baja producción de IL-1, IL-2 e INF-g , y descenso de la actividad del factor tímico en suero (34, 35).
Es indudable que existen marcadas semejanzas entre los cambios que el envejecimiento produce en el sistema inmune y los que causa la desnutrición. La malnutrición proteico-calórica esta presente en el 50% de los ancianos hospitalizados y representa la principal causa de inmunodeficiencia en los ancianos (6). La MPC junto al envejecimiento ejercen efectos acumulativos sobre la respuesta inmune, induciendo una declinación aguda de la inmunidad en los animales o humanos envejecidos con baja ingesta de proteínas (1,3). Lesourd y cols. (3) encontraron que en ancianos aparentemente sanos, la disminución moderada en los niveles de albúmina estuvo asociada a una disminución aún mayor de las células T CD3+ maduras y a un incremento mayor en las células T CD2+CD3- inmaduras, además la proliferación linfocitaria y la síntesis de IL-2 también están más disminuidas. Estos cambios concurrieron con la caracterización previa de la respuesta inmune "normal" en las personas ancianas. La principal diferencia que se encontró es que en los ancianos sin disminución de los niveles de albúmina los linfocitos T CD8+ mostraron valores más bajos mientras que los linfocitos CD4+ permanecieron comparables a los de adultos más jóvenes. En contraste, los ancianos aparentemente sanos con disminución moderada de la albúmina tuvieron valores de linfocitos T CD4+ más bajos.
En los sujetos ancianos con MPC, todos los parámetros de inmunidad celular están disminuidos por debajo de los niveles encontrados en el envejecimiento "normal": número de células T (CD3+,CD4+), proliferación linfocitaria, síntesis de citoquinas (IL-2, IL-6), e hipersensibilidad cutánea retardada, además en los ancianos la MPC está asociada con disminución de las respuestas de anticuerpos a vacunas. La desnutrición en el anciano añade a los cambios inmunes propios de envejecimiento, una disminución de la síntesis de la IgA secretora, de la lisozima y del interferon, además de que reduce la actividad del complemento (16). La intensidad del déficit inmune es proporcional al grado o de MPC (1,3,6).
La MPC no solamente afecta a los linfocitos sino que también disminuye las funciones de monocitos y neutrófilos, por ejemplo, la liberación de IL-1 se encuentra reducida en humanos con MPC (36,37). La IL-1 en asociación con otras monoquinas tales como el factor de necrosis tumoral a (FNT-a ), IL-6, factor de transformación del crecimiento b , IL-8, o IL-11 representan el núcleo central de todos los síndromes inflamatorios. De esta forma, la MPC puede modificar los síntomas clínicos de la inflamación en ancianos desnutridos: por ejemplo, existe una baja liberación de IL-1 en estos ancianos durante las infecciones y aunque estos pacientes están realmente infectados, en algunos no se observan signos de fiebre. Esta situación clínica conduce a diagnósticos erróneos y retarda el tratamiento. Los síndromes inflamatorios entonces tienen un período de evolución más largo en los ancianos. Más aun, la liberación baja de citoquinas es también responsable del descenso de la movilización de las reservas nutricionales corporales, conduciendo a un insuficiente suministro de nutrientes a los linfocitos y un deterioro de los mecanismos de defensa (1).
Se han llevado a cabo diversos estudios para demostrar que la recuperación nutricional es un medio eficiente para restaurar la respuesta inmune de ancianos malnutridos. El suplemento de 400 a 500 kcal/d es suficiente para mejorar algunos de los índices de la inmunidad celular (proliferación de células T e hipersensibilidad retardada). Este efecto se ha observado con alimentos comerciales listos para usar que contienen un tercio de todas las raciones dietéticas recomendadas (RDAs) pero no existe información sobre cuales fueron los principales nutrientes relacionados al mejoramiento de los parámetros. Apartando estas limitaciones, se ha podido concluir que el efecto producido sobre el sistema inmune se observa sólo durante el periodo de suplementación (1).
Los lípidos son esenciales para la integridad estructural y funcional de las membranas celulares. Los eventos de membrana están integralmente involucrados en todos los aspectos de la reactividad inmune celular. Tanto el tipo como la cantidad de lípidos de la dieta modulan la actividad inmune por medio de diferentes vías (10). Los aspectos inmunoregulatorios de la composición lípidica dietaria son inherentemente interesantes y pueden tener particular relevancia en los individuos ancianos, en quienes el perfil lípidico tiende a incrementarse. Las cualidades inmunosupresivas del alto contenido de grasa dietaria pueden potenciar o contribuir a la declinación natural de la actividad inmune con la edad y consecuentemente exacerbar las enfermedades relacionadas con la inmunidad.
El envejecimiento se acompaña de cambios en la composición de ácidos grasos de los fosfolípidos de las células T. En tal sentido se ha observado disminución de ácidos grasos saturados como el ácido miristico y el ácido palmitico así como un concomitante incremento de un ácido graso insaturado como el ácido araquidónico; tales alteraciones son únicas para los linfocitos y puede contribuir a la declinación con la edad de la función linfocitaria (38). El grado de saturación de los ácidos grasos (AG) esterificados a los lípidos de membrana es un aspecto importante ya que éste puede alterarse dramáticamente por el nivel de ingesta de AGs, además, el grado de insaturación (número de dobles enlaces) de los AGs constituyentes perturba la configuración molecular y la fluidez de la membrana celular (10). Así los ácidos grasos saturados (como el palmitico y el esteárico), la reducción de la relación AG poliinsaturados/AG saturados en la membrana o el incremento del contenido de colesterol reducen la fluidez de membrana, lo cual se ha relacionado con el mejoramiento de la respuesta mitogénica. Por el contrario, los ácidos grasos insaturados incrementan la fluidez de la membrana, y esto se ha asociado a inmunosupresión (10,39). Adicionalmente se ha observado que tanto las grasas saturadas como poliinsaturadas elevan el índice mitótico de los timocitos y el índice de involución tímica in vivo, lo que puede acelerar y agravar el deterioro de la función inmune durante la senescencia (40).
Los ácidos grasos dietarios n-3 y n-6 pueden ejercer sus efectos sobre el sistema inmune a través de mecanismos como regulación de la expresión genética, regulación de las señales de transducción, y regulación de la producción de eicosanoides y citoquinas, probablemente el más significativo de estos mecanismos sea el relacionado con las citoquinas (41). Los ácidos grasos insaturados deprimen la producción de la IL-2, una de las interleuquinas más importantes para la proliferación linfocitaria y que precisamente en el anciano se ve disminuida. Tal efecto probablemente explique la inhibición que sobre la proliferación linfocitaria estimulada por mitógenos causan los ácidos grasos como el ácido óleico, linóleico, alfa-linóleico, araquidónico, eicosapentanoico y docosahexaenoico (42,43).
Específicamente el ácido linóleico, un AG esencial omega-6 (18:2), suprime la función inmune y se asocia con atrofia del tejido linfoide tanto a altos como a bajos niveles. La deficiencia de dicho AG deprime la respuesta de anticuerpos, las ingestas de este AG menores o iguales al 4% de las calorías totales están relacionadas con tumorogénesis y aquellas mayores o iguales a 15% de las calorías totales deprimen la inmunidad al deteriorar la función de las células T (4). El ácido graso linóleico junto al araquidónico se conocen como precursores de prostaglandinas, y se ha postulado que estos tienen un efecto inmunosupresivo mediante el incremento de la síntesis de dichas moléculas (10).
Por su parte, el consumo de una dieta baja en grasa y rica en AG omega-3 puede tener efectos perjudiciales sobre la función inmune. Al ser comparados con sujetos ingiriendo dietas bajas en pescado, en adultos sanos mayores de 40 años que consumían dietas altas en pescado se ha observado una disminución del porcentaje de células T ayudadoras y de la producción de citoquinas además de una reducción de la respuesta de hipersensibilidad retardada (4). Meydani y cols., (44) han demostrado que la suplementación con bajos niveles de ácidos grasos n-3, como el ácido eicosapentenoico (EPA) y el ácido docosahexaenoico (DHA), suprime la producción inducible de IL-1b , FNT, IL-2 y de IL-6, siendo más dramática la supresión en mujeres de mayor edad; dicha suplementación también redujo significativamente la respuesta mitogénica frente a la PHA, pero este efecto sólo se observó en las mujeres ancianas. Mientras la suplementación de ácidos grasos n-3 puede ser beneficiosa en terapias anti-inflamatorias o en la disminución de la severidad de las enfermedades autoinmunes, sus efectos supresivos sobre la inmunidad mediada por células en adultos ancianos pueden ser obviamente no deseables (44).
En relación a las lipoproteínas (LP) circulantes, éstas interactúan con receptores de membrana específicos sobre los linfocitos y se ha demostrado que inhiben la blastogénesis inducida por mitógenos y antígenos. Las lipoproteínas como las lipoproteínas de densidad intermedia (IDL) tienen receptores específicos saturables sobre las membranas de las células T y se ha demostrado que su unión a tales receptores interrumpe la secuencia de eventos en la membrana iniciados por la fitohemaglutinina; también la IDL interfiere con la acumulación de Ca+2 bloqueando efectivamente así la progresión de los eventos (10). Cuando se añade a los cultivos celulares el suero de ancianos, que es rico en lipoproteínas de muy baja densidad (VLDL) y lipoproteínas de baja densidad (LDL), se inhibe la proliferación dependiente de IL-2 de las células T. Al parecer el incremento de estas LP puede afectar el acceso de las citoquinas a los receptores de membrana (4). Por último, si la síntesis de colesterol endógeno, un evento que parece ser un prerequisito esencial en las respuestas linfocitarias proliferativas a fin de adecuar la formación de nuevas membranas, se encuentra bloqueada directa o indirectamente los eventos proliferativos se detienen proporcionalmente, se deterioran las respuestas mitogénicas y disminuye la citotoxicidad (10).
En resumen, aunque las interacciones bioquímicas especificas y precisas no han sido completamente dilucidadas, esta claro que los lípidos dietarios tienen efectos inmunoregulatorios a través de alteraciones de los constituyentes lípidicos celulares y de la actividad a nivel de membrana (10).
El zinc ha sido estudiado extensamente en el anciano. La deficiencia de este micronutriente se observa usualmente en la malnutrición proteico-calórica ya que éste es transportado mayormente por la albúmina, aunque también se ha reportado tal déficit en un 30 al 40% de los ancianos sin signos de MPC que viven en sus hogares (1). Interesantemente, las alteraciones inmunes que acompañan a la deficiencia de este oligoelemento son muy semejantes a las encontradas en la MPC (45). La deficiencia de zinc puede estar ligada a muchas causas, como insuficiente ingesta, baja absorción, o incremento de la excreción renal (lo cual se asocia con insuficiencia renal o con un alto consumo de diuréticos), es decir, a todas las situaciones patológicas que a menudo se observan en los ancianos (1). El contenido de zinc es alto en proteínas de la carne y bajo en dietas basadas en cereales, por lo tanto, no es sorprendente que en los ancianos exista déficit de zinc (16), así se ha reportado que el 90% de los ancianos de vida libre no alcanza la RDA de 15 mg/día del nutriente, de tal forma que se puede suponer que una moderada o indetectable deficiencia de zinc puede ser parte del proceso "normal" de envejecimiento de la función inmune (3).
El zinc es un elemento traza de gran importancia para la proliferación celular. De hecho, el zinc es el cofactor de muchas enzimas involucradas en la división celular; más aun, el zinc es un cofactor de la timulina, una hormona tímica implicada en la proliferación de los timocitos que solamente es activa cuando está unida al zinc (1). La timulina induce marcadores de diferenciación en las células T inmaduras en el timo y periféricamente, modula la secreción de citoquinas en las células mononucleares de sangre periférica (CMSP) y, en unión con la IL-2, induce proliferación de las células T CD8. El zinc influencia las células T maduras, e induce la expresión de receptores de alta afinidad para la IL-2 (46). El zinc regula la homeostasis de los linfocitos no solamente por mantenimiento de la proliferación sino también por supresión de la muerte, es decir, por inhibición de la apoptosis (45,46). El zinc modula la actividad citolítica de las células T, influencia la actividad de las células asesinas naturales y estimula a los monocitos para que liberen IL-1, IL-6 y FNT-a (47).
La deficiencia de zinc, la cual es más frecuente en las edades extremas de la vida, induce inmunodeficiencia celular, hecho que se asemeja a las disfunciones que usualmente son observadas en personas de edad avanzada, ya que provoca defectos tímicos con depleción de las células tímicas y disminución de la actividad de la timulina en asociación con la aparición de células T inmaduras en sangre periférica o disminución de la proliferación linfocitaria. Adicionalmente el déficit de zinc reduce la síntesis de IL-2, la generación de células T citotóxicas, y las respuestas de hipersensibilidad retardada, deteriora la actividad de las células asesinas naturales, la fagocitosis de los macrófagos y neutrófilos, la quimiotaxis y la generación de radicales oxidativos (3,46,47). La deficiencia de zinc también provoca pérdida excesiva de las células precursoras T y B en la médula ósea conduciendo a linfopenia o a una falla para reponer el sistema linfocitario (45).
La suplementación con zinc revierte la deficiencia de las células T observada en la vejez, en parte por la restauración de la función de la hormona tímica timulina (3,11); este efecto algunas veces se encuentra con dosis iguales a la RDA (1). Con la adición de zinc in vitro, la secreción disminuida de IFN-a que muestran los ancianos se restituye (46). La suplementación de zinc también mejora la producción de IL-1, la actividad de la ecto 5´nucleótidasa, las respuestas a las pruebas cutáneas y la agudeza gustativa (otra función que se deteriora con el déficit de zinc) (16). Por último es interesante hacer notar que, la suplementación de altas dosis de zinc (7 a 8 veces el valor fisiológico), más bien inhibe las funciones de las células T y bloquea la inducción de IFN-a en los individuos de edad (46).
El balance oxidante-antioxidante es muy importante dentro de la función celular inmune, no solamente por el mantenimiento de la integridad y funcionalidad de los lípidos de la membrana, de las proteínas celulares y de los ácidos nucleicos, sino también para el control de la transducción de señal y de la expresión genética en las células inmune. Las células del sistema inmune son particularmente sensibles a los cambios en este balance debido a que existe un mayor porcentaje de ácidos grasos poliinsaturados en sus membranas plasmáticas y a que están frecuentemente expuestas a un alto número de intermediarios de oxigeno reactivo que producen como parte de su función normal. (48).
Se requieren concentraciones optimas de antioxidantes para mantener la respuesta inmune en todos los grupos etarios. No obstante, este requerimiento puede ser aun más critico en las personas ancianas. Es bien conocido que el incremento de la formación de radicales libres y de la peroxidación lípidica contribuye, al menos en parte, a la disregulación de la respuesta inmune en el envejecimiento (48) ya que los metabólitos del oxígeno, especialmente el peróxido de hidrógeno, producidos por los macrófagos activados disminuyen la proliferación linfocitaria (16). De esta forma se ha propuesto que la ingesta de nutrientes antioxidantes en los ancianos, en virtud de su influencia en el equilibrio oxidante-antioxidante, es un importante determinante de su respuesta inmune (48).
Específicamente, la vitamina E es el antioxidante liposoluble más efectivo en las membranas biológicas, encontrándose especialmente en altas concentraciones a nivel de las membranas de las células inmunes. Su deficiencia en humanos daña la función mediada por células T, observándose depresión de las respuestas de hipersensibilidad retardada, de las respuestas mitogénicas a la concanavalina A y a la fitohemaglutinina, y reducción de la producción de IL-2; además se deteriora la capacidad bactericida y quimiotáctica de los neutrófilos (49,50), mientras que se ha asociado positivamente la citotoxicidad de las células asesinas naturales con el nivel de vitamina E en plasma (51).
Los ancianos muestran bajo consumo de diversos micronutrientes, entre ellos la vitamina E. Un estudio ha reportado que el 50% de las personas ancianas (60 años de edad en promedio) tuvieron ingestas de vitamina E por debajo de dos tercios de la RDA; otra investigación reporta que un 40% de los ancianos se encuentra en esta situación (48). De esta forma el anciano esta en grave riesgo de sufrir imbalance de vitamina E, lo cual puede acentuar aun más la inmunosenescencia.
La inmunidad en poblaciones ancianas puede ser mejorada a través de la suplementación de vitamina E y aunque la RDA para dicha vitamina es de 10 y 8 mg de equivalentes de tocoferol para hombres y mujeres respectivamente, lo cual se considera adecuado para prevenir los síntomas de deficiencia no relacionados con la inmunidad (ej. neuropatías y miopatías) (50), se ha sugerido que se requieren ingestas más elevadas que la RDA para mantener una respuesta inmune optima, ya que los estudios de suplementación así lo confirman. En un estudio doble ciego placebo controlado, Meydani y sus cols. (52) suplementando 34 sujetos sanos mayores de 60 años con 800 mg dl-a -tocoferol (400 mg/cápsula dos veces al día) por 30 días lograron incrementar la respuesta de hipersensibilidad retardada, la respuesta mitogénica a Con A y la producción de IL-2. La suplementación también disminuyó la producción de prostaglandina E2 (PGE2) estimulada por PHA en las CMSP así como los niveles de peróxidos lípidicos plasmáticos; la producción de IL-1 y la respuesta mitogénica inducida por PHA en las CMSP no se afectó. Por otro lado, la suplementación de 400 mg de a -tocoferol dos veces al día por 48 horas antes de una carrera en pendiente previno en ancianos el aumento inducido por el ejercicio de la IL-1 y la IL-6 (49), así dado que dichas interleuquinas han sido implicadas en los procesos inflamatorios, la respuesta de fase aguda, la proteolisis y daño muscular inducido por ejercicio, estos resultados indican que además de mejorar la inmunidad celular la vitamina E puede afectar las consecuencias catabólicas de los procesos inflamatorios y de la respuesta de fase aguda al modular la síntesis de citoquinas (50).
Para evaluar el efecto de la suplementación a largo plazo y la concentración óptima de vitamina E en la respuesta inmune de personas ancianas, Meydani y cols. (50) condujeron un segundo estudio doble ciego placebo controlado en 80 ancianos sanos de vida libre (> 65 años) quienes fueron asignados a uno de cuatro grupos: placebo, 60, 200, o 800 mg/día de dl-a -tocoferol por 235 días. No existieron efectos sobre el nivel de dos autoanticuerpos (anti-ADN y anti-tiroglobulina) o en la capacidad de los neutrófilos para eliminar C. Albicans, sin embargo, los datos sugirieron que mientras la suplementación con 60 mg/día de vitamina E pudo mejorar la hipersensibilidad retardada, esta no fue adecuada para provocar un incremento significativo en los títulos de anticuerpos contra hepatitis B o toxoide tetánico mientras que la suplementación con 200 mg/día de vitamina E, por su parte, causó un significativo incremento tanto de la respuesta de hipersensibilidad retardada como de los anticuerpos, y la magnitud de la respuesta para ambos índices fue más alta que la observada en los otros dos grupos de suplementación. También se demostró que la capacidad para eliminar C. albicans no fue afectada a cualquiera de las dosis de vitamina E aplicadas (60-800 mg/día), siendo ésto de importancia dado que una de las consideraciones a las dosis altas de vitamina E es que ésta puede afectar negativamente la fagocitosis y la actividad bactericida de los polimorfonucleares. Los autores concluyeron que 200 mg/día representan el nivel optimo de vitamina E para la respuesta inmune, sugiriendo que puede existir un nivel umbral para el efecto inmunomodulatorio de la vitamina E. La ingesta de 200 mg/día de vitamina E sólo puede ser posible a través de suplementación, y la inclusión de dicha cantidad a la dieta diaria junto a 5-8 raciones de frutas y vegetales seguramente mejoraría la función inmune en los últimos años de vida (53).
El mecanismo mediante el cual la vitamina E cumple un rol inmunopotenciador dentro del envejecimiento no ha sido completamente dilucidado. La vitamina E es un antioxidante, pero se ha demostrado que el efecto de esta vitamina sobre el sistema inmune no puede ser totalmente explicado a través de esta propiedad (48). Así, por ejemplo, a la par de que se ha sugerido que un alto contenido dietario de vitamina E mejora la proliferación linfocitaria tímica a través del incremento de la diferenciación de las células T en el timo (54) también se ha reportado que la suplementación de vitamina E disminuye la síntesis de PGE2 en los timocitos (48). Parte del efecto inmunoestimulante de la vitamina E sobre la mitogénesis de las células T pudiera consistir en un efecto indirecto de la vitamina sobre los macrófagos activados, ya estos secretan factores supresivos como el peróxido de hidrogeno (radical libre) y la PGE2 que pueden deprimir la proliferación linfocitaria. Los ensayos de suplementación con vitamina E tanto en animales como en humanos han demostrado disminución de la producción de PGE2 y de peróxidos lípidicos en plasma (48). No sólo se ha observado que el incremento de la síntesis de PGE2 en el macrófago durante el envejecimiento es debido a que se encuentra favorecida la actividad y expresión de la cicloxigenasa sino que también se ha comprobado que la suplementación de vitamina E revierte completamente el aumento de la actividad de dicha enzima (55).
La vitamina C, como la vitamina E, es un nutriente antioxidante pero de naturaleza hidrosoluble, por tanto también interviene en el mantenimiento del balance oxidante-antioxidante en las células que componen el sistema inmune. Los fagocitos y linfocitos almacenan la vitamina C en concentraciones 100 veces mayores a las encontradas en el plasma y las mismas se reducen cuando los fagocitos son activados, así mismo el timo también concentra altos niveles de esta vitamina. La vitamina C puede modular las funciones de los fagocitos (por ej. la quimiotaxis) así como la actividad de las células asesinas naturales y las funciones y proliferación de los linfocitos. También puede afectar la producción de proteínas inmunes como las citoquinas, anticuerpos y componentes del complemento (56,57). La deficiencia de vitamina C tanto en animales como en humanos disminuye la función de los neutrófilos, deteriora la hipersensibilidad cutánea retardada, y causa concentraciones séricas anormales de complemento (58,59). En estudios clínicos se ha descrito reducción de la respuesta fagocítica, de la capacidad para eliminar agentes extraños, y de la respuesta de anticuerpos y los estudios en humanos con escorbuto experimentalmente inducido, han demostrado una respuesta linfocitaria anormal a la estimulación in vitro con mitógenos de células T sin cambios en las subpoblaciones de linfocitos (59).
La disminución de la ingesta y el pobre estado nutricional de la vitamina C en ancianos se han tomado como factores contribuyentes a la alta prevalencia de enfermedades. Diversos estudios han observado una asociación entre bajos niveles de ingesta de vitamina C o bajos niveles sanguíneos de esta vitamina con alto riesgo de muerte, pero algunos estudios de suplementación no han conseguido disminuir las tasas de mortalidad en ancianos con bajos niveles séricos de ácido ascórbico (60).
La administración intramuscular de 500 mg/día de vitamina por un mes a 20 ancianos mayores de 70 años logro incrementar la proliferación linfocitaria estimulada por PHA y Con A, adicionalmente se incrementó la respuesta de hipersensibilidad retardada frente a la tuberculina. Sin embargo, los resultados de este trabajo no fueron apoyados por mediciones del estado de la vitamina C antes y después de la suplementación, por lo tanto, se desconoce si el efecto se debió a una acción inmunoestimulante directa de la vitamina o a la correción de una posible deficiencia (61). Otro estudio encontró que aunque la adición in vitro de vitamina C a los linfocitos de ancianos eleva la proliferación estimulada por Con A a niveles comparables a los de sujetos jóvenes, la suplementación in vivo con 2 g/día de la vitamina por tres semanas no afectó significativamente las respuestas mitogénicas ni revirtió la anergia (62). Por otro lado, se ha observado elevación significativa de los niveles de IgG, IgM y de C3 en ancianas recibiendo 400 mg de ácido ascórbico (63).
Aunque los resultados de los estudios de suplementación con vitamina C en los ancianos son alentadores, no todos son coincidentes y no permiten emitir conclusiones definitivas, por lo que se requieren más investigaciones cuyo diseño permita un mejor control de las variables.
El fosfato-5’de piridoxal (PLP) es la forma coenzimática predominante de la vitamina B6, dicha vitamina participa en una gran variedad de reacciones metabólicas la mayoría de las cuales están involucradas en el metabolismo de aminoácidos y proteínas, incluyendo la síntesis de estas últimas (64). Muchas de las sustancias producidas durante la respuesta inmune, como anticuerpos y citoquinas, son precisamente proteínas (57) por lo que entre los diversos nutrientes involucrados en el mantenimiento y función del sistema inmune se encuentra la vitamina B6.
Aun cuando la influencia del déficit de vitamina B6 ha sido estudiada ampliamente en animales, las investigaciones en humanos son limitadas. Sin embargo, la evidencia disponible sugiere que, al igual que en los animales, el sistema inmune humanos sufre daños cuando se hace presente dicha deficiencia nutricional. En animales, una deficiencia de vitamina B6 causa profundos cambios en el sistema inmune. El tejido linfoide más severamente afectado es el timo y la actividad de la hormona tímica está reducida. En la mayoría de las especies animales se observa linfopenia. El deterioro de la inmunidad mediada por células se evidencia por fallas en las reacciones cutáneas de hipersensibilidad retardada, reducción de la citotoxicidad de los linfocitos T, así como por un retardo del rechazo a los transplantes de piel. El daño en las respuestas humorales se manifiesta con pobre producción de anticuerpos después de inmunizaciones primarias o de refuerzo. Tanto los linfocitos T como los linfocitos B exhiben respuestas proliferativas deprimidas cuando son estimulados in vitro con antígenos o mitógenos (64). En los ancianos se ha observado que el estado de la vitamina B6 esta positivamente relacionado a los porcentajes de las subpoblaciones de células T, así los porcentajes más bajos de células T CD5 y CD4 se encuentran en ancianos con estado de vitamina B6 más bajo mientras que los porcentajes más elevados se presentan en ancianos con el estado de vitamina B6 más alto (65).
La deficiencia de vitamina B6 es muy común en ancianos enfermos institucionalizados y no es rara en ancianos de vida libre. Se ha postulado que tal déficit nutricional juega un importante rol en la respuesta inmune de las personas ancianas (3) dado que la declinación del estado de la vitamina B6 en el anciano coincide con la inmunosenescencia. Las razones que explican tal desequilibrio nutricional con el avance de la edad no son realmente aparentes. De acuerdo a los pocos estudios disponibles, muchos de los ancianos pueden tener una inadecuada ingesta dietaria de vitamina B6 (64); entre 4 a 29% de los ancianos europeos no alcanzan la RDA para vitamina B6 (3). Además de una ingesta dietética inadecuada, la nutrición de la vitamina B6 puede estar comprometida por baja biodisponibilidad o baja absorción, excesivas pérdidas, incremento de los requerimientos, y uso de alcohol o de otras drogas que reaccionan con la vitamina (64).
Talbott y cols. (66) investigaron el efecto de la suplementación de 50 mg/d de piridoxina por dos meses sobre la función linfocitaria en 15 ancianos y observaron que la proliferación linfocitaria se elevo significativamente en respuesta a PHA, al mitógeno pokeweed (PWM) y al Staphylococcus aureus (SAC). Los porcentajes de células CD3+ y CD4+ pero no de CD8+ aumentaron significativamente en sujetos tratados con piridoxina. La suplementación fue más efectiva en aquellos ancianos con los más bajos niveles plasmáticos de PLP, sugiriendo que el mejoramiento del estado de la vitamina B6 en los ancianos es importante en la estimulación de la inmunocompetencia. Mas recientemente, como parte de una investigación mayor para establecer el requerimiento de esta vitamina en ancianos, Meydani y cols. (67) estudiaron el efecto de la depleción y repleción de vitamina B6 sobre la respuesta inmune en ocho ancianos sanos. La depleción de vitamina B6 disminuyó significativamente el porcentaje y número total de linfocitos, las respuestas mitogénicas de los linfocitos de sangre periférica a mitógenos de células T y B (PHA, Con A y SAC), y la producción de IL-2. Para la mayoría de los sujetos, pero no para todos, estos parámetros retornaron a los niveles basales después de la tercera fase de repleción donde las ingestas de vitamina B6 fueron de 1,90 mg/día para las mujeres y de 2,88 mg/día para los hombres. El porcentaje y el número total de linfocitos, sin embargo, no retorno a los niveles basales, incluso después del período final de suplementación. Estos hallazgos sugirieron que para el mantenimiento de la función normal inmune, los ancianos requieren cantidades de vitamina B6 más altas que las recomendadas actualmente, sin embargo, no esta claro si estos altos requerimientos son específicos para la respuesta inmune del anciano o para la respuesta inmune en general sin distinción de edad.
Las lesiones bioquímicas que originan los efectos de la deficiencia de vitamina B6 sobre la función inmune no están completamente dilucidados. Los primeros estudios sugirieron síntesis disminuida de ADN, y por ende, deterioro de la síntesis de ARN. Cuando los linfocitos se enfrentan a un antígeno bajo estas condiciones, la subsecuente respuesta inmunológica contra éste no es presumiblemente adecuada ya que ésta requiere del incremento de la síntesis de ADN, ARN y proteínas (64). La disminución de la producción de IL-2 y la proliferación linfocitaria observada por Meydani y cols. (67) pueden ser parcialmente explicadas por un descenso tanto en el porcentaje como en el número total de linfocitos (particularmente de células T ayudadoras, las cuales producen la IL-2) dado que dichas respuestas inmunes dependen de la síntesis de ADN, ARN, y proteínas (49).
La función inmune declina con la edad y los cambios aparecen en mayor extensión dentro de la inmunidad celular. Probablemente la involución tímica sea uno de los factores más preponderantes y el origen de muchas de las alteraciones inmunes relacionadas con la edad; adicionalmente el timo parece ser particularmente vulnerable a imbalances nutricionales. Existe un efecto sinergístico y/o acumulativo al solaparse los desequilibrios nutricionales con la función inmune subóptima provocada por la senescencia. En el anciano al igual que en otras edades, la funcionalidad del sistema inmune depende de muchos nutrientes, no obstante, para este grupo etario algunos de los más relevantes son aquellos que integran el sistema antioxidante del organismo. La suplementación de los nutrientes revisados es beneficiosa al restaurar o prevenir la declinación de la respuesta inmune en los ancianos y, específicamente para nutrientes como la vitamina E y la vitamina B6 los estudios sugieren que tales beneficios se alcanzan al ingerir estas vitaminas en proporciones mayores a las actualmente recomendadas. En la búsqueda de medios que permitan modificar positivamente la función inmune del anciano y con ello mejorar su calidad de vida, la nutrición es uno de los factores que, sin duda alguna, siempre debe ser implementado.