Con la finalidad de evaluar la influencia de la temperatura de almacenamiento sobre los cambios post mortem en híbridos de cachama (Colossoma macropomum x Piaractus brachypomus) cultivados, se almacenaron 80 ejemplares de pescado, bajo tres temperaturas: 0ºC (hielo), 10ºC (agua mas hielo) y 27± 3ºC (ambiente). Durante el almacenamiento se evaluó el desarrollo de rigor mortis (IR), concentración de adenosina trifosfato (ATP), adenosina difosfato (ADP), adenosina monofosfato (AMP), inosina monofosfato (IMP), inosina (HxR), hipoxantina (Hx) por HPLC e índice de frescura (valor K). En los pescados almacenados a 0ºC se presentó una contracción violenta, con valores de IR máximo de 100% en 2 horas, mientras que a 10ºC la máxima contracción se presentó después de 10 horas y a 27± 3ºC, el máximo valor de IR fue de 82,97% después de 24 horas. La tasa de hidrólisis de ATP fue mayor durante las primeras 24 horas en los pescados almacenados a 10ºC, seguido por los almacenados a 27± 3ºC y por los almacenados a 0ºC. El valor K, se incrementó más lentamente en los pescados a 0ºC que en las otras temperaturas. En todas las temperaturas se observó una correlación positiva significativa (p<0,05) de los valores K con el tiempo de almacenamiento (r0ºC = 0,931; r10ºC = 0,946; r27ºC = 0,945). Los híbridos de cachama permanecieron muy frescos hasta 14 días a 0ºC, hasta 7 días a 10ºC y hasta 8 horas a 27± 3ºC. An Venez Nutr 2001; 14(2): 53-59.
Palabras clave: Cachama cultivada, cambios post motem, frescura.
Post mortem changes and freshness of commercially cultured cachama hybrids (Colossoma macropomum x Piaratus brachypomus) stored at: 0ºC (ice), 10ºC (ice and water) and 27± 3ºC (ambient) were studied. Changes on rigor index (RI), adenosine triphosphate (ATP), adenosine diphosphate (ADP), adenosine monophosphate (AMP), inosine (HxR), hypoxanthine (Hx) concentration and freshness index (K value) were measured during the storage period. Fishes stored at 0ºC showed a quick and violent muscle contraction and its maximum tension (RI 100%) was attained between 2 hours of storage, but when stored at 10ºC, the maximum tension was attained after 10 hours. The fishes stored at 27± 3ºC exhibited a maximum RI of 82,97% after 24 hours of storage. The ATP degradation rate, measured by HPLC, showed that ATP was hydrolyzed rapidly during the first 24 hours in fishes stored at 10ºC, followed by those stored at 27± 3ºC and the ATP hydrolysis was slow in fishes stored at 0ºC. K value changed at a lower rate in fishes stored at 0ºC than when stored at higher temperatures and a significant correlation (p<0,05) with storage time (r0ºC = 0,931; r10ºC = 0,946; r27ºC = 0,945) was found. These results indicate that cultured cachama could keep good freshness quality for up to 14 days when stored at 0ºC, 7 days at 10ºC and 8 hours at 27± 3ºC. An Venez Nutr 2001; 14(2): 53-59.
Key words: Cultured cachama, post mortem changes, freshness.
La piscicultura se ha desarrollado vertiginosamente en los últimos años como una de las mejores opciones para satisfacer la demanda de proteína animal a bajo costo (1-3). En Venezuela esta actividad ha comenzado con el cultivo de camarón, trucha y cachama, siendo el cultivo de la cachama, entre las especies continentales, el que ha tenido mayor auge por presentar características favorables para su cultivo, alcanzando su producción de 618 toneladas para 1994 (4). Sin embargo, no todo el pescado que se cultiva llega a ser utilizado eficientemente como alimento debido a que una gran cantidad se pierde durante el almacenamiento, transporte y venta(5).
En el pescado, inmediatamente después de la muerte y durante su transporte y comercialización, se suceden una serie de reacciones autolíticas en el músculo, que conllevan a la acumulación o desaparición de adenosina trifosfato (ATP) y sus compuestos relacionados que inciden sobre la frescura del pescado(6). La hidrólisis de ATP, adenosina difosfato (ADP) y adenosina monofosfato (AMP) hasta su conversión en inosina monofosfato (IMP) ocurre rápidamente después de la muerte del pez , alrededor de 24 horas en la mayoría de las especies de pescado(7, 8). Por el contrario, la degradación de IMP a inosina (HxR) e hipoxantina (Hx) es lenta(9, 10), de manera que el IMP se acumula en el músculo de pescado durante un cierto tiempo(11-13). Además se ha demostrado que el IMP incide sobre el desarrollo de aroma y sabores agradables del pescado muy fresco y es ampliamente utilizado en Japón como un agente saborizante(14). Debido a que esta serie de reacciones de desfosforilación y desaminación del ATP y sus compuestos de degradación se suceden, en el pescado refrigerado, en la primera etapa de los cambios post-mortem, se han utilizado las concentraciones de cada uno de estos compuestos como indicadores biológicos del grado de frescura (15-19). Utilizando estos indicadores, Saito et al.(20) desarrollaron una ecuación incorporando las concentraciones de todos los productos de la degradación de ATP, cuyo valor es conocido como el valor K, y es definido como un porcentaje de la relación entre la suma de las concentraciones de HxR e Hx y la suma de las concentraciones de ATP y de sus catabolitos.
Por otra parte, la disminución en las concentraciones de ATP en el músculo trae como consecuencia el desarrollo del rigor mortis, el cual es considerado como uno de los más prominentes cambios post-mortem que ocurren en el tejido animal en la temprana etapa después de la muerte(21). En este sentido se ha observado que el retardo del rigor mortis es beneficioso para mantener la frescura del pescado y se han estudiado diversas condiciones que afectan su desarrollo, tales como el estado fisiológico y la fatiga antes de la muerte, el método de sacrificio y la temperatura de almacenamiento(22-25). Con relación a este último parámetro, se ha observado que en algunas especies de aguas tropicales el inicio del rigor mortis es más rápido cuando el pescado se almacena a 0ºC que a mayores temperaturas(23, 26-28). Existe entonces una necesidad comercial de conocer la temperatura de almacenamiento que sea más beneficiosa para mantener una óptima frescura de la cachama cultivada en Venezuela y así disminuir la pérdida post captura.
El objetivo del presente trabajo fue estudiar en híbridos de la cachama cultivada, el efecto de la temperatura de almacenamiento sobre el desarrollo de rigor mortis y la frescura.
Se evaluaron tres lotes de híbridos de cachama (Colossoma macropomum x Piaractus brachypomus) cultivada comercialmente en San Carlos, Edo. Cojedes, con un peso promedio de 398,31± 64,85 g y una longitud promedio de 23,00± 1,13 cm. Todos los pescados, inmediatamente después de la captura antes de ser almacenados, fueron sacrificados mediante una incisión realizada a nivel de las branquias.
Cada lote se dividió en tres grupos y cada grupo se almacenó en cavas a temperaturas reguladas de: 0ºC (hielo), 10± 3ºC (agua mas hielo) y 27± 3ºC (temperatura ambiente). A lo largo del período de almacenamiento (dos semanas), se tomaron muestras de músculo dorsal de tres ejemplares seleccionados al azar de cada temperatura de almacenamiento. La toma de muestras se realizó cada dos horas durante el primer día y cada dos días por el período restante.
Se determinó la composición proximal en una muestra formada por el músculo dorsal de tres ejemplares de cada lote. El contenido de humedad, proteína, grasa y cenizas se determinó según el procedimiento descrito en AOAC, 1980(29).
El IR se determinó en cinco ejemplares de cada temperatura de almacenamiento utilizando el método propuesto por Bito et al.(30). Para su determinación se colocó sobre una tabla horizontal la mitad anterior del pescado, mientras que la mitad posterior se mantuvo suspendida fuera de la tabla. Luego se midió con una escuadra, a intervalos de tiempo establecidos, la distancia entre la base de la aleta caudal y el eje horizontal de la tabla. El IR se calculó según la siguiente ecuación:
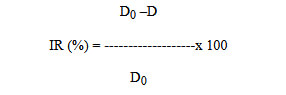
Donde D0 y D representan la distancia que separa la base de la aleta caudal del eje horizontal, medidos al inicio del almacenamiento y a intervalos definidos de tiempo, respectivamente.
La concentración de ATP y sus compuestos de degradación (ADP, AMP, IMP, HxR e Hx) se determinaron por el método de Iwamoto et al.(23), con las siguientes modificaciones. Para la extracción de ATP y sus compuestos de degradación se tomaron 5 g de músculo dorsal y se homogeneizaron con 15 ml de ácido perclórico al 10% frío. El homogenato se centrifugó a 4.000 r.p.m. durante 10 min y el sobrenadante se ajustó a un pH entre 6,0 – 7,0 con hidróxido de potasio al 50% y se centrifugó nuevamente. El sobrenadante resultante se llevó a 50 ml y se almacenó a –40ºC hasta la cuantificación de ATP y sus compuestos de degradación por cromatógrafo de alta resolución (HPLC), marca "Waters", modelo 510. Las condiciones para la separación y cuantificación de ATP y sus compuestos de degradación fueron: columna Novopack C-18 (4 mm x 3,9 mm x 15 cm), sistema isocrático de solventes con una fase móvil de buffer fosfato pH 4,2 - 4,3, velocidad de flujo de 0,4 ml/min, detector de UV-VIS, modelo 486, ajustado a 254 nm y un volumen de inyección de muestra de 15 m l. Se utilizaron como estándar de referencia ATP, ADP, AMP, IMP, HxR y Hx adquiridos en Sigma Chemical Company.
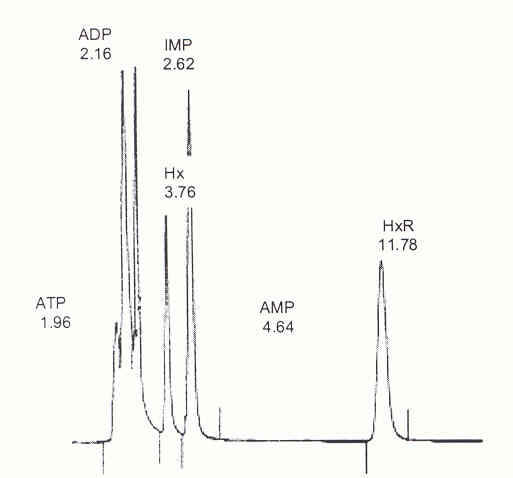
La Figura 1 muestra el cromatograma de una mezcla de ATP y sus catabolitos ADP, AMP, IMP, HxR e Hx separados. El orden de elusión de la columna fue: ATP, ADP, IMP, Hx, AMP e HxR
Una vez obtenidas las concentraciones de ATP y cada uno de sus catabolitos se calculó el índice de frescura (valor K) utilizando la siguiente ecuación propuesta por Saito et al. (20):
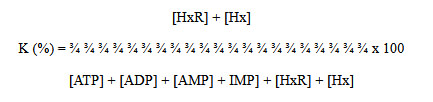
Según este índice, cuando el pescado está muy fresco, bajas concentraciones de HxR e Hx, se tiene un valor K bajo, el cual aumenta gradualmente al ir perdiendo su frescura. Dependiendo de la especie, se establece como muy fresco un valor K menor de 20%; fresco entre 20 a 40%; incipiente deterioro entre 40 a 60% y totalmente deteriorado mayor de 60%.
Los resultados fueron analizados mediante análisis de varianza multifactorial, a un nivel de significancia de 5% y 1%, utilizando el programa Statgraphics, versión 6.0. Las figuras y sus respectivas DS fueron trazadas por el Microcal Origin, versión 41.
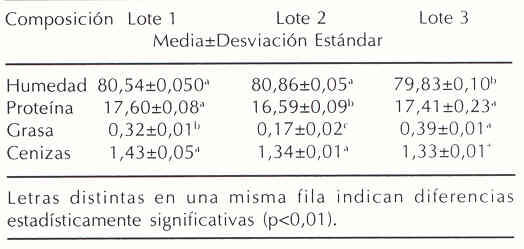
En el Cuadro 1 se presenta la composición química proximal de híbrido de cachama. El contenido de humedad, proteína y grasa varían significativamente (p<0,01) de un lote a otro; sin embargo, todos los valores se encuentran dentro de los valores normales correspondientes al pescado; en general de 16-21% de proteína, 0,2-25 % de grasa y 1,2 –1,5 % de cenizas y 66-81% de humedad(31).
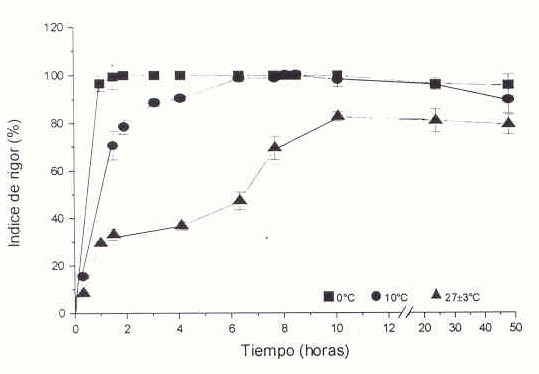
El efecto de la temperatura de almacenamiento sobre el IR se observa en la Figura 2. Las tasas más aceleradas de contracción muscular se presentaron en los pescados almacenados a 0ºC, los cuales alcanzaron el estado de máximo rigor (100% de IR) 2 horas después del almacenamiento a esta temperatura. Por el contrario a 10ºC, el estado de máximo rigor se alcanzó después de 10 horas de almacenamiento, mientras que a 27± 3ºC, el rigor mortis se desarrolló lentamente y el valor máximo fue de 82,7%, alcanzado después de 10 horas de almacenamiento. Resultados similares fueron observados en pargo (Pagrus major)(22) y en platija (Paralichtys olovaveus)(23). A pesar de que el desarrollo del rigor en los pescados almacenados a 0ºC fue muy acelerado, el tiempo de permanencia en el estado de máximo rigor fue relativamente largo, 8 horas; en comparación con los pescados almacenados a 10ºC, en los que este tiempo fue de 2 horas. El tiempo de duración del estado de máximo rigor en pescados almacenados a 27± 3ºC fue solo de 1 hora.
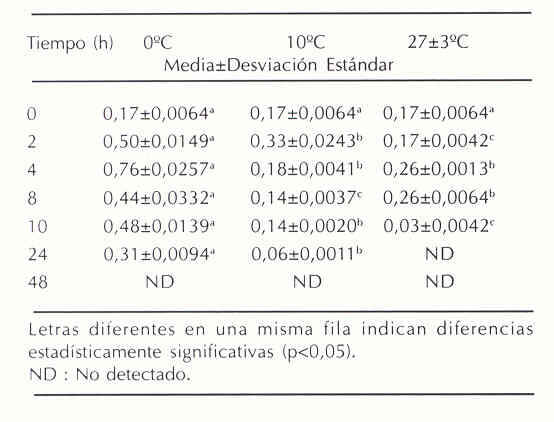
En el Cuadro 2 se presentan los resultados de los cambios en la concentración de ATP del músculo dorsal de híbridos de cachama almacenados a diferentes temperaturas. En los pescados almacenados a 0ºC la concentración de ATP se incrementó gradualmente hasta 4 horas de almacenamiento, no mostrando relación entre la hidrólisis de ATP y los valores de IR. Por otro lado, en los pescados almacenados a 10ºC y a 27± 3ºC, se observó que a partir de 2 horas y 8 horas respectivamente, las concentraciones de ATP muscular comenzaron a disminuir con el consecuente aumento en el IR, encontrándose, para ambas condiciones de almacenamiento, una correlación negativa significativa entre la concentración de ATP y los valores de IR (p<0,01).
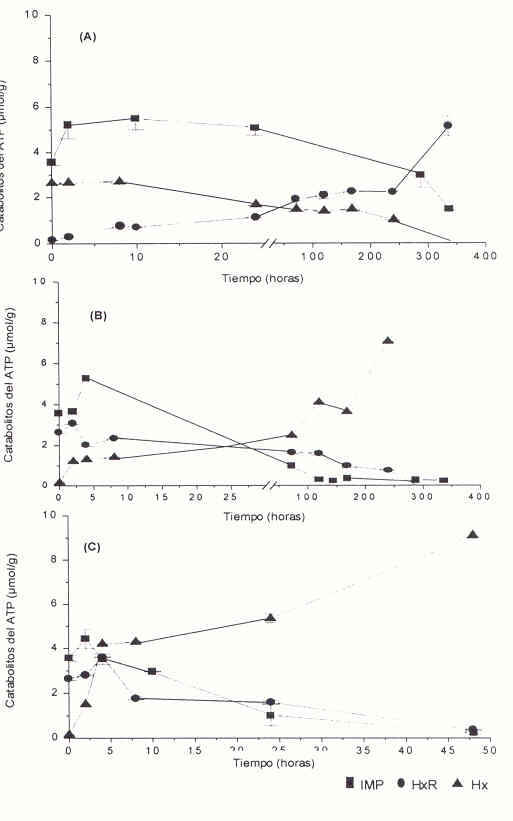
En la Figura 3 se muestra la influencia de la temperatura de almacenamiento sobre la tasa de acumulación e hidrólisis de IMP, HxR e Hx en el músculo dorsal de híbridos de cachama durante su almacenamiento. Se observó que, independientemente de la temperatura de almacenamiento, se produjo un comportamiento similar en cuanto a las variaciones de las concentraciones de IMP, HxR e Hx. No obstante, se observaron diferencias significativas en la velocidad de estos cambios (p<0,05) dependiendo de la temperatura de almacenamiento. Durante el inicio del almacenamiento se presentó una etapa caracterizada por el incremento en las concentraciones de IMP, este período es muy breve en los pescados almacenados a 10ºC y 27± 3ºC, mientras que en los pescados almacenados a 0ºC este período se extendió hasta 24 horas.
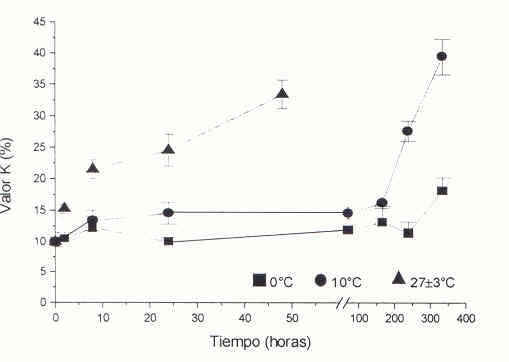
En la Figura 4 se presentan los resultados del valor K, observándose que este valor incrementó más lentamente cuando los híbridos de cachama se almacenaron a 0ºC, siendo menor a 20% luego de 336 horas (14 días) de almacenamiento. Mientras que en híbridos almacenados a 10ºC y 27± 3ºC, se excedió rápidamente el límite de máxima frescura (valor K = 20%) establecido por Ichikawa(38), presentándose valores superiores a 20% luego de 168 horas (7 días) de almacenamiento a 10ºC y luego de 8 horas de almacenamiento a 27± 3ºC.
El bajo contenido de grasa presentado por híbridos de cachama cultivados, al contrario de lo observado por otros autores(39), pudo estar relacionado con su grado de madurez, ya que los ejemplares utilizados en el presente trabajo eran relativamente pequeños, aun cuando su talla y peso estaban dentro del tamaño comercial (300 g – 500 g de peso corporal). Sin embargo, por su alto contenido en proteína y bajo contenido en grasa se podría clasificar a estos ejemplares como pescado de grado A, de acuerdo a la clasificación propuesta por Stansby(40).
El endurecimiento muscular que se presenta en el pescado, a las pocas horas después que este muere, es conocido como el rigor mortis, el cual es una manifestación física de diferentes reacciones bioquímicas que se suceden en el músculo de pescado.
Desde el punto de vista de la frescura; es más ventajoso alargar el tiempo del inicio y la duración del rigor mortis, siendo más largo el tiempo del inicio a medida que el pescado es almacenado a más bajas temperaturas. Sin embargo, en los híbridos de cachama la instauración del rigor fue más rápida y violenta cuando se almacenaron a 0ºC y más lenta a 27± 3ºC.
En diferentes trabajos se ha demostrado que cuando la concentración del ATP disminuye en el músculo, se acelera el desarrollo del rigor mortis(6, 23, 32, 33). Este comportamiento se observó en los ejemplares almacenados a 10ºC y a 27± 3ºC, es decir a 10ºC hubo un incremento rápido en los valores de IR provocado, probablemente, por la rápida hidrólisis de ATP; mientras a 27± 3ºC, la lenta tasa de hidrólisis de ATP provocó igualmente un lento incremento en los valores de IR. Por el contrario, en híbridos almacenados a 0ºC, no se observó relación entre el incremento del IR y la hidrólisis de ATP. Este tipo de comportamiento a 0ºC, ha sido reportado también para otras especies de aguas tropicales (26-28), por lo que se concluyó que este fenómeno es provocado por una reacción violenta de las especies tropicales ante el almacenamiento en frío y se denominó el fenómeno de "cold shock".
La velocidad de hidrólisis de IMP disminuyó a medida que descendió la temperatura de almacenamiento. Igualmente, la velocidad de los cambios en las concentraciones de los compuestos formados por la hidrólisis de IMP, la HxR y la Hx, fue igualmente más lenta a medida que descendió la temperatura de almacenamiento. Estos resultados explican el incremento más lento del valor K a 0ºC que a 10ºC y éste a su vez más lento que a 27± 3ºC. El lento aumento del valor K a bajas temperaturas parece obedecer a la disminución en la velocidad de desfosforilación del IMP, debido a la inhibición de la 5´nucleotidasa(33), más que a la concentración de ATP, ADP o AMP. En relación con esto se ha observado que, en el músculo del pescado, la hidrólisis de ATP, AMP, ADP hasta IMP ocurre rápidamente, desapareciendo luego de 24 horas de almacenamiento como consecuencia de la desaminación y desfosforilación parcial del ATP(7,8), de esta manera el IMP tiende a acumularse seguido por la HxR. Igualmente, en híbridos de cachama, el AMP y el ADP se presentaron en cantidades no cuantificables (Datos no mostrados).
Generalmente, cuando los niveles de IMP comienzan a disminuir, las concentraciones de HxR e Hx aumentan(34-36). Sin embargo, en híbridos de la cachama se observó que los niveles de HxR no aumentaron cuando disminuyeron las concentraciones de IMP mientras que si se incrementaron los niveles de Hx a expensas de IMP. La velocidad con que ocurre la hidrólisis y la acumulación de IMP, HxR e Hx fue mayor a medida que se incrementó la temperatura de almacenamiento, ocurriendo estas reacciones más rápidamente a 27± 3ºC que a 10ºC y ésta a su vez más rápida que a 0ºC.
Desde la introducción del valor K por Saito et al.(20) , como una expresión de la frescura de pescado más satisfactoria, este índice ha sido utilizado por diferentes autores para definir la frescura de pescado en forma más objetiva(10,13,19,23,37). Según este índice, los bajos valores K indican que el pescado está más fresco. En híbridos de cachama, independientemente de la temperatura de almacenamiento, los incrementos en el valor K presentaron una correlación significativa (p<0,05) con el tiempo de almacenamiento (r0ºC = 0,931; r10ºC = 0,946; r27ºC = 0,945), lo cual permite proponer al valor K como un estimador objetivo de la frescura en híbridos de cachama cultivados.
En conclusión, de acuerdo con los índices de frescura obtenidos en el presente trabajo, se pueden considerar a los híbridos de cachama como muy frescos (alrededor de 20% de valor K) hasta los 14 días de almacenamiento a 0ºC, 7 días a 10° C y 8 horas a 27± 3° C.
Los autores desean expresar su agradecimiento al Consejo Nacional de Investigaciones Científicas y Tecnológicas por el financiamiento parcial de este trabajo a través del Proyecto No. S1-2419.