Los folatos, constituyen cofactores fundamentales para los procesos bioquímicos que conducen a la sintesis y eventual modificación epigénetica de ácidos nucleicos e histonas. Además, su metabolismo está intimamente relacionado al metabolismo de la homocisteina. Se han descrito numerosas causas de mal funcionamiento del ciclo metabólico de folatos, la causa más frecuente y quizas la más relevante desde el punto de vista de salud pública es la deficiencia nutricional. El papel central del folato en la sintesis y posteriores modificaciones epigenéticas del material genético, por una parte, así como su relación con la homeostasis de la homocisteina, lo han asociado a dos tipos de patologías de gran importancia en salud pública: a) Enfermedades cardiovasculares y b) Defectos del desarrollo embrionario. En la actualidad, su papel en el riesgo cardiovascular es sujeto de controversia ya que estudios clínicos poblacionales no lo respaldan, sin embargo, si existe evidencia clara de su papel en la aparición de defectos del desarrollo embrionario, especificamente aquellos centrados en el tubo neural y el sistema cardio-circulatorio. Estas evidencias, llevaron a proponer diversos modelos programáticos en salud pública para prevenir y tratar a nivel poblacional el deficit nutricional de folatos. De los varios modelos ensayados, la fortificación obligatoria de ciertos alimentos de consumo masivo ha demostrado ser el mas exitoso y es actualmente implementado en 54 paises a nivel mundial. En Venezuela, desde la decada del 2000 se ha demostrado experimentalmente una seria deficiencia nutricional de folato, que afecta a más del 70% de la población femenina en edad fertil. A pesar de los múltiples llamados hechos a los responsables de las politicas de salud en el país, Venezuela sigue siendo uno de los pocos paises en la región que no ha implementado un programa de fortificación. Su implementación no requiere de una fuerte inversión oficial, pero si debe ser acompañado de un programa eficiente de seguimiento que permita a) evaluar los beneficios y b) las posibles modificaciones en su implementación. An Venez Nutr 2015; 28(1): 21-27.
Palabras clave: Folatos, deficiencia nutricional de folatos, programa de fortificación, Venezuela
The folate cofactors are essential for the biochemical processes that lead to the eventual synthesis and epigenetic modification of histones and nucleic acids. In addition, their metabolism is closely related to homocysteine metabolism. While there have been described numerous causes malfunction folate metabolic cycle, the most common and perhaps the most important cause, from the point of view of public health, is nutritional deficiency. The central role of folate in the synthesis and subsequent epigenetic modifications of genetic material, on the one hand, and their relationship with the homeostasis of homocysteine, have been associated with two types of diseases of great public health importance: a) Cardiovascular Diseases b) Defects of embryonic development. Currently, its role in cardiovascular risk is the subject of controversy since this have not received support from population trials , however, there is clear evidence of their role in the onset of embryonic development defects, specifically those focused on the neural tube and the cardio-circulatory system. This evidence, led to propose different program models in public health, at the population level, to attack the nutritional deficit of folates. Of the several models tested, mandatory fortification of certain foods for mass consumption has proved the most successful and is currently implemented in 54 countries worldwide. In Venezuela, since the 2000s it has been shown, experimentally, a serious nutritional folate deficiency, which affects over 70% of the female population of childbearing age. Despite numerous appeals made to those responsible for health policies in the country, Venezuela remains one of the few countries in the region that has not implemented a program of fortification. Its implementation does not requires a strong government investment, but must also be accompanied by an effective monitoring program that allows a) evaluation of the potential benefits and b) support rational implementation of any necessary changes. An Venez Nutr 2015; 28(1): 21-27.
Key words: Folate, nutritional folate deficiency, program of fortification, Venezuela
Investigador Emerito, IVIC. Miembro Nacional Correspondiente, Academia Nacional de Medicina.
Solicitar correspondencia a: Rafael Apitz-Castro: rapitz@gmail.com
El término “folato” identifica a todos los compuestos naturales, capaces de generar intermediarios con la actividad biológica del ácido pteroylmonoglutámico (ácido fólico). El ácido fólico es una de las vitaminas del grupo B cuya función biológica consiste fundamentalmente en servir como intermediario donador de grupos metilo (-CH3) en el llamado ciclo de “una unidad de carbono”. Los folatos naturales están constituidos mayoritariamente por pteroyl-poliglutamatos, conteniendo entre dos y siete unidades de glutamato, con una muy baja proporción de la forma mono-glutamil (ácido fólico). Los derivados poliglutamicos, requieren de una serie de transformaciones metabólicas que los lleven a la forma monoglutámica para ser absorbidos por el enterocito y de esa forma se integrarse al ciclo de metilación (1-3).
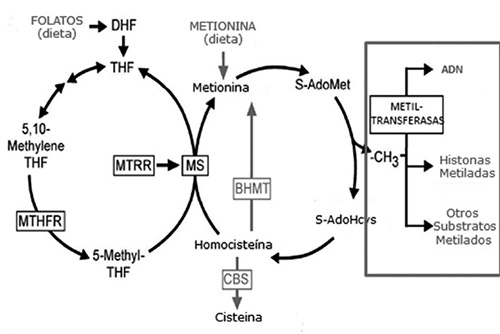
Bajo condiciones fisiológicas, la forma monoglutamato, pasa rápidamente a la circulación portal para su procesamiento en el hígado. En el hepatocito, los folatos son transformados en las formas reducidas, dihidro- y tetrahidrofolato (DHF y THF), por las correspondientes reductasas. La Figura 1 muestra la estrecha interrelación entre las vías metabólicas correspondientes al ciclo de la homocisteína/metionina y las vías responsables por las transformaciones metabólicas de folatos, vitamina B12 y vitamina B6. Del buen funcionamiento de estas vías metabólicas dependen los dos mecanismos más importantes del proceso de metilación (incorporación de unidades de un solo carbón) en proteínas, ácidos nucleicos y otros metabolitos relevantes para la vida celular. Hoy día, es de especial importancia el papel que este ciclo metabólico juega en los procesos que regulan las modificaciones epigeneticas del genoma (4).
Los valores de folato plasmático (P-folato) y eritrocítico (E-folato) recomendados por la OMS se muestran en la Figura 2 (5,6). El folato eritrocitario corresponde a las reservas y representa el nivel estacionario de folatos, con menor variación temporal que el folato plasmático. Sin embargo, una alta y consistente correlación entre ambos parámetros y entre ellos y los niveles de homocisteinemia ha validado el uso clínico del nivel de P-folato.

Un buen número de factores pueden ser responsables por las alteraciones de los niveles de folato. Sin embargo, las más comunes son: a) Deficiencias vitamínicas secundarias a malas condiciones nutricionales; b) Uso médico de anti-folatos (Metotrexato, anti-epilépticos) y c) Mutaciones en alguna de las enzimas involucradas en las vías metabólicas ya referidas. De estas, la más corriente es el polimorfismo C677T en el gen que codifica para la Reductasa del METILTETRAHIDROFOLATO, abreviada MTHFR. Esta variante además de ser termolabil, tiene una actividad menor del 65% de la enzima normal.
Los niveles poblacionales de folato se miden determinando la concentración de ácido fólico en sangre (5,6).
En Venezuela, los estudios epidemiológicos de los niveles de folato, vitamina B12 y homocisteina han sido escasos. Vizcaino y colaboradores publicaron en 2001 y 2005 dos estudios en nativos de las etnias Yupka y Wayuu, en los cuales evaluaron 80 y 60 sujetos respectivamente. En esas evaluaciones no se encontró deficiencia de folato y la prevalencia del polimorfismo C677T fue de un 15% (7,8). Martí-Carvajal y colaboradores publicaron en 2007 resultados de un estudio en pacientes afectados de HIV(n = 80) en el estado Carabobo (9), donde demuestran una prevalencia de hiperhomocisteinemia (> 15 μmoles/L) de 23 %, así como deficiencia de folato plasmático en 19 % y de vitamina B12 en 9 % de la muestra estudiada.
Para el año 2001, no existía estudio poblacional realizado en Venezuela que abordara en su conjunto, la relación entre los niveles plasmáticos de homocisteína, como factor de riesgo emergente, y el estado nutricional de la población en cuanto a los niveles plasmáticos de folato y de las vitaminas B12 y B6. Es de hacer notar que los niveles de homocisteina plasmática constituyen un marcador sensible de los defectos en el metabolismo de folato y/o vitamina B12 (5,6,10). En el año 2001, el laboratorio de Trombosis Experimental del centro de Biofísica y Bioquímica del IVIC implementó un protocolo de tipo poblacional para, entre otros parametros, determinar los niveles plasmáticos de homocisteina y por supuesto ácido fólico y vitamina B12 en Venezuela. Para el año 2001, estudios globales de ese tipo no habían sido publicados en Venezuela. Quizás, los únicos datos existentes eran los obtenidos por el Dr. Miguel Layrisse en el marco del Proyecto Venezuela, pero estos no habían sido publicados.
El estudio en cuestión se realizó en las ciudades importantes de los estados que acumulan la mayor densidad poblacional del país, con excepción del Edo. Zulia, donde se llevaba a cabo un estudio enfocado hacia el sindrome metabólico. El carácter voluntario del protocolo indudablemente que introducía un sesgo, en el sentido de que una gran mayoría de los participantes iban a ser personas que de cierta forma se preocupaban por su estado de salud, con un aceptable estilo de vida y estabamosconcientes de que sus resultados probablemente serían el reflejo del mejor escenario posible. El muestreo se realizó en comunidades populares y en zonas de clase media, incluyendo colegios (11,12).
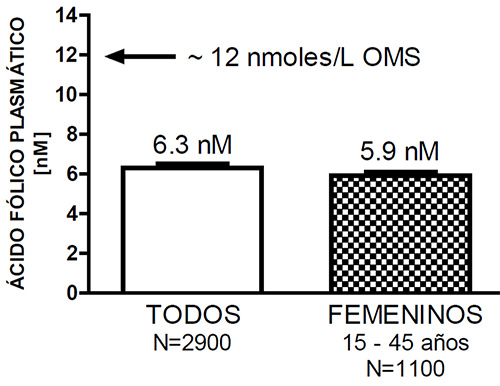
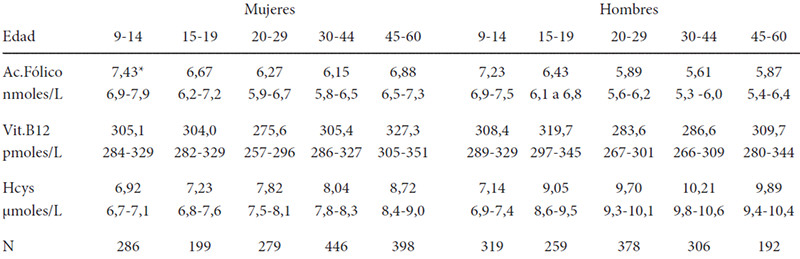
El análisis preliminar de los valores de folato plasmático en la sub-población de mujeres aparentemente sanas, en edad fértil (15 a 45 años de edad, N = 1100)(11), demostróque el 89.5 % de las evaluadas presentaba valores por debajo de 10 nmoles/L y, que el valor promedio era de 5.96 nmoles/L con un intervalo de confianza de 95% de 5.75 a 6.18 nmoles/L (Figura 3). Como mencionamos mas arriba, estos valores se encuentran en el límite superior de lo que se consideraría como deficiencia severa. El cuadro 1 muestra un extracto de los datos obtenidos del análisis final del estudio (12). Este Cuadro muestra los valores de fólico y B12 estratificados por género y rango etario. Es claro, que mientras no observamos deficiencia de vitamina B12, si es importante notar que la deficiencia de ácido fólico es prácticamente global e independiente del género y el rango etario. Es de observar que en el análisis final, los niveles de ácido fólico resultaron ligeramente superiores a los previamente obtenidos, aun cuando se mantenían en los límites superiores, que caracterizan la deficiencia severa. En ésta tabla se han incluido los valores de homocisteina plasmática porque esos valores, que podrían considerarse dentro del rango apropiado, no se compaginan con los valores tan bajos de ácido fólico. Una posible explicación estaría en el hecho de que la homocisteina es un aminoácido no proteico que es sintetizado en el organismo a partir de la metionina, éste es un aminoácido esencial, solo adquirido de la dieta. La deficiente calidad de la dieta del venezolano quizás abundante en calorías, pero no en calidad nutricional (13, 14), sería responsable por la baja ingesta de metionina, que podría traducirse en una menor síntesis de homocisteína.
Los resultados de nuestro informe preliminar del 2004 (11) fueron confirmados en un excelente estudio poblacional en el Estado Vargas, que incluyó 5658 muestras de suero, obtenidas en tres evaluaciones realizadas durante el periodo 2001-2002, que además, incluyó el análisis de 4564 muestras de suero de la encuesta realizada por el Proyecto Venezuela en 1980.Este estudio fue liderado por la Dra. Maria Nieves Garcia, del Centro de Medicina Experimental del IVIC y publicado en 2005 (15). De especial significado, es que en el estudio poblacional del Edo. Vargas, a tres años del desastre natural de 1999, se reporta un nivel de deficiencia de ácido fólico (< 6 nmoles/L) en 53,3% de los niños y adolescentes estudiados, mientras que solo de 21% en relación a valores bajos de vitamina B12. Es de hacer notar, que en el estudio mencionado se incluyeron 1289 embarazadas del área de la Gran Caracas.
En esta sub-población, se encontró que 36% presentaban valores bajos o deficientes de ácido fólico, 61% deficiencias en vitamina B12, con una mayor prevalencia en los sectores más vulnerables de la población.
Es claro entonces, de los resultados obtenidos en estos estudios poblacionales, que para los periodos cubiertos (2000 – 2004), existía una deficiencia importante nutricional, reflejada en la elevada prevalencia de deficiencia de folatos y de hiperhomocisteinemia en la población general, independiente del rango etario, el género o el nivel socio-económico.
La combinación de una dieta de muy pobre calidad nutritiva, con un déficit importante de la ingesta de ácido fólico tiene importantes consecuencias en el área de la salud pública. Hasta el presente, no habiéndose implementado medidas tendientes a mejorar esa situación lamentable en materia de salud pública, creemos que en el mejor de los casos la situación continúa igual.
Desde el punto de vista de salud, Hibbard y Smithells en 1965 (16) fueron los primeros en asociar la deficiencia nutricional de folato con la alta incidencia de defectos del tubo neural (DTN) en las comunidades pobres de Liverpool, donde ejercían como gineco-obstetras. Hoy en día, está clara la estrecha relación entre alteraciones metabólicas en el ciclo de metilación (homocisteína, folatos) y la aparición de defectos variables del desarrollo embrionario (17). Es indudable, que la calidad de vida, desde el punto de vista nutricional juega un importante papel. Por ejemplo, en el nor-oeste de los Estados Unidos se definió un periodo entre 1920 y 1949 de una mayor prevalencia, con un pico entre 1929 y 1932, los años de la depresión (18). En Holanda, hubo un pico de prevalencia en el invierno de 1944-1945, llamado el invierno de hambre, periodo de la 2ª Guerra Mundial en que hubo el mayor desabastecimiento de alimentos frescos (19). Otro dato concordante es la publicación por Duff y colaboradores (20), donde reportan un aumento de tres veces en DTN en Jamaica despues del huracan que destruyó una gran parte de la vegetación de la isla. A título anecdótico, un comentario publicado en la misma revista y relacionado al reporte de Duff, indicaba que la Sra. Catherina Schrader, partera que practicaba en la región de Friesland, Holanda entre 1693 y 1745, había llevado un registro cuidadoso de sus 3100 partos atendidos, registrando 6 casos de DTN, equivalentes a 1.9 por 1000 nacidos vivos. Lo llamativo, aparte de la rigurosidad de la Sra. Catherina fue que estos casos ocurrieron en dos periodos: 1722/1723 y 1732/1733, ambos años posteriores a cosechas inusualmente pobres en la región (21).
Después de los defectos cardiacos, los defectos del tubo neural (DTN) son los defectos estructurales congénitos más comunes a nivel mundial (Figura 4). El termino DTN define, en general, una malformación embrionaria del cerebro y/o de la médula espinal.

La espina bífida, en cualquiera de sus modalidades, presenta la mayor prevalencia a nivel mundial, del orden de 1.5 a 2.0 por mil nacidos vivos, aunque esta cifra presenta ciertas variaciones, dependiendo de los países. Por otra parte, estas cifras, no revelan la realidad ya que se basan en nacidos vivos, aunque la frecuencia es unas 10 veces mayor si se incluyen los fetos nacidos muertos.
En la última década, a las patologías mencionadas, claramente derivadas en gran parte al menos, de la disfunción del metabolismo de folatos, se le han ido agregando otras patologías congénitas, como el síndrome de Down (trisomía 21) y la enfermedad de Hirschsprung o megacolon aganglionico, caracterizada por la ausencia parcial de células ganglionares simpáticas a nivel del colon. Defectos con manifestaciones clínicas más sutiles, no aparentes al momento del nacimiento, también han comenzado a asociarse. Un estudio prospectivo reciente, realizado en una cohorte de madres e hijos en Noruega, entre 1999 y 2008, en el cual se evaluó durante los tres primeros años el desarrollo del lenguaje en 38954 niños, demostró que el uso materno de la suplementación con ácido fólico en el periodo pre-concepcional estuvo asociado a una disminución significativa de defectos asociados al lenguaje (22).
Los mecanismos moleculares que involucran el metabolismo de folatos en la aparición de estos defectos del desarrollo neural no están dilucidados. Por una parte, se ha demostrado que la homocisteinaper se demuestra efectos teratogénicos, probablemente asociados a su interacción con el receptor de N-Metil-D-Aspartato (NMDA), involucrado en la maduración de sinapsis, y en el establecimiento de otras conexiones intercelulares funcionales. Por otra parte, la disfunción de estas vias metabólicas se manifiesta por alteraciones variables en la síntesis y metilación de ácidos nucleicos que van a dar lugar a inestabilidad de ADN, errores en la reparación, segregación cromosómica anormal, así como patrones aberrantes de metilación de histonas y otras proteínas.
Si éste panorama es ya de por si serio, lo agrava la aparición de una serie de publicaciones a finales de 2013 y en los tres últimos meses de 2014, donde se demuestra que las modificaciones epigenéticas (fundamentalmente debidas a metilación) son altamente dinámicas, con una demetilación global que se sucede en el embrión humano al nivel de las primeras cuatro células, seguida rápidamente por remetilación de novo, altamente dependientes del ciclo de transferencia de unidades de metilo que hemos mencionado (3,23-25). Éste proceso es muy similar en humanos y en ratones, y se ha demostrado que en ratones sometidos a dietas deficientes en folatos, las mutaciones epigenéticas pueden ser transmitidas hasta por cinco generaciones (26). Por otra parte, publicaciones recientes (27, 28), muestran evidencias experimentales que indican que el estatus del folato del padre, no solo de la madre, puede ser de igual relevancia en términos del desarrollo embrionario de la descendencia.
Por todo lo expuesto y considerando la carga social que enfrentan las familias en las cuales nacen niños/niñas con algún defecto del desarrollo embrionario, aunado al alto coste del tratamiento (cuando está disponible) de estos defectos, parece muy razonable el considerar los problemas de salud asociados a deficiencias nutricionales en general, y a la de ácido fólico en particular, como un serio problema de salud pública, cuya prevención debe ser tomada en cuenta seriamente por las autoridades correspondientes. Las medidas preventivas son harto conocidas y han sido aplicadas con éxito en un buen número de países: fortalecimiento obligatorio de alimentos de consumo masivo, con ácido fólico sintético. Este enfoque tiene la gran ventaja de no ser discriminatorio desde el punto de vista socio-económico y de tener una relación coste/beneficio altamente favorable (29).
En Venezuela, desde hace algunos años se viene especulando sobre la promulgación de un decreto oficial que ordenaría la implementación de la fortificación obligatoria,con ácido fólico, de los alimentos de consumo masivo. Lamentablemente, ese decreto no se ha hecho aún efectivo. Dada la posibilidad de que algún día éste sea implementado, es urgente iniciar la ejecución previa de estudios poblacionales que permitan, por una parte, actualizar al menos la línea basal de los niveles de ácido fólico, y por otra, establecer un registro nacional de defectos del desarrollo embrionario. Estos dos parámetros serían de gran ayuda para el seguimiento de un eventual programa de fortificación.
Hasta el presente, no habiéndose implementado medidas tendientes a mejorar esa situación lamentable en materia de salud pública, creemos que en el mejor de los casos la situación descrita para 2004 (11-14) no se ha modificado.
A este respecto, la Academia Nacional de Medicina comenzó desde mediados de 2013 un protocolo de estudio de la incidencia de estos defectos a nivel nacional. Hasta el momento han participado siete hospitales públicos con servicios de Obstetricia, que atienden la mayor cantidad de pacientes en los estados Sucre, Carabobo, Aragua, Mérida, Zulia y la Gran Caracas. Para el periodo de estudio (2013-2014), sobre un total de 27000 partos, el análisis preliminar de los datos arroja una prevalencia de defectos del desarrollo embrionario (de todo tipo), de 6.5 por 1000 nacidos vivos (en países desarrollados, esa misma cifra se expresa por 10000 nacidos vivos). De este total, los defectos que han sido demostrados como asociados a deficiencia de ácido fólico (Cardiocirculatorios y defectos del tubo neural) corresponden a 2.94 por 1000 nacidos vivos. Ésta última cifra, triplica la prevalencia de estos defectos en la gran mayoría de países de la región, que ya están aplicando los correspondientes programas de prevención. Las cifras de prevalencias calculadas en el análisis preliminar deben considerarse como “conservadoras”, ya que a) no se pudo abarcar la totalidad de entidades nacionales y b) por razones obvias, no toma en cuenta defectos de tipo cognitivo, que solo son aparentes durante el desarrollo del niño. Como sugerencia final, sería deseable que esta iniciativa de la Academia Nacional de Medicina despertara interés por el problema y se lograra implementar un Registro Nacional de Defectos del Desarrollo Embrionario en todo el país. Entre otros beneficios, tal registro permitiría hacer un seguimiento racional de las medidas preventivas que eventualmente sean implementadas, y ayudaría a integrar rápidamente los cambios que fuesen necesarios para la obtención del mayor beneficio.
Recibido: 12-03-2015
Aceptado: 28-06-2015