El Síndrome Metabólico (SM) comprende alteraciones antropométricas, clínicas y metabólicas predisponentes del desarrollo de diabetes tipo 2 y enfermedades cardiovasculares; resulta de la interacción de factores genéticos y ambientales mediados por regulación epigenética; algunos loci pueden tener mayor efecto en los fenotipos metabólicos modificados por la dieta u otros factores ambientales. Una vez caracterizados los componentes del SM, diversos estudios se enfocan en identificar los mejores predictores de riesgo cardio-metabólico en adultos: obesidad central (CCi) y resistencia a la insulina (RI). La obesidad gestacional y RI en tejidos fetales se asocian a riesgo alto de SM en niños y adolescentes. En adultos jóvenes: mayor prevalencia de HTA y RI en nacidos pretérmino (peso al nacer < 1500 g) vs nacidos a término, sin diferencias significativas en perfil lipídico entre ambos. Estudios recientes reportan asociación entre suministro bajo de ácidos grasos ώ-3 y elevado de ώ-6 en < 2 años con características posteriores del SM: dislipidemia, RI e hiperfagia. Adolescentes obesos no diabéticos con SM tenían menores habilidades aritméticas, de deletreo, atención y flexibilidad mental y más probabilidades de desempeño inadecuado en las evaluaciones cognitivas que sus pares saludables. Se encontraron reducciones de la integridad microestructural en la materia blanca y menores volúmenes del hipocampo, capaces de ocasionar complicaciones cerebrales a corto plazo. Se ha descrito adelanto fisiológico de indicadores de maduración sexual y ósea (MO) en obesos, pero se carece de información en SM; el análisis individual en obesos de 9-16 años con SM evidenció alto porcentaje de MO adelantada. An Venez Nutr 2014; 27(1):96-100.
Palabras clave: Síndrome metabólico, obesidad central, resistencia a la insulina, niños, adolescentes.
Metabolic Syndrome (MS) includes anthropometric, clinic and metabolic changes that predispose to the development of diabetes type 2 and cardiovascular diseases. MS results from the interaction of genetic and environmental factors mediated by epigenetic regulation; some loci have greater effect on metabolic phenotypes modified by diet and other environmental factors. Once MS components are characterized, several studies focus on the best predictors to identify cardiometabolic risk in adults: Waist circumference (WC) and insulin resistance (IR). Obesity during pregnancy and IR in fetal tissues is associated to high risk of MS in children and adolescents. In young adults there is a higher prevalence of high blood pressure and IR in children born preterm (weight < 1500 g) vs. children born at term, without significant differences in lipidic profile between both groups. Recent studies have proposed the association between low intake of ώ-3 and high intake of ώ-6 fatty acids in infants with latter appearance of MS characteristics: dyslipidemia, IR and hyperphagia. Non-diabetic obese adolescents with MS were found to have lower arithmetic skills, spelling and mental flexibility and inappropriate performance in cognitive evaluations when compared with their healthy peers. Decreased microstructural integrity of the white matter and smaller hippocampus volume that may cause cerebral complications at short time was found. Early physiological puberty and skeletal development have been described in obesity, but no information is available in obese patients with MS. In obese 9-16 years old, we found high percentage of advanced bone age in those with MS criteria. An Venez Nutr 2014; 27(1): 96-100.
Key words: Metabolic syndrome, central obesity, insuline resistance, children, adolescents.
1Grupo de transición Alimentaria y Nutricional (TAN). Fundación Bengoa.
Solicitar correspondencia a Coromoto Macías de Tomei: e-mail: coritomei@gmail.com
El Síndrome Metabólico (SM) se está convirtiendo en uno de los principales problemas de salud pública del siglo XXI. Su diagnóstico implica aumentar en cinco veces el riesgo de padecer diabetes tipo 2 y en dos a tres veces el de enfermedad cardiovascular (1,2). El SM comprende alteraciones antropométricas, clínicas y metabólicas, que predisponen el desarrollo de enfermedades cardiometabólicas en etapas posteriores de la vida (3).
Actualmente no existe un acuerdo internacional en relación a la definición del SM en niños y adolescentes ya que algunos autores siguen los lineamientos propuestos por el Programa Nacional de Educación sobre Colesterol (NCEP) en el marco del III Panel de tratamiento en adultos (ATP III) (4-7) y otros los propuestos por la Federación Internacional de Diabetes en 2007 (IDF por sus siglas en inglés) (8). Existen diferencias entre valores de referencia y variables a ser consideradas; por ello su definición se complica, ya que en estos grupos etarios se presentan cambios durante el crecimiento y desarrollo (3,9). Se dispone de clasificaciones para el diagnóstico del SM en niños y adolescentes: NCEP-ATP III, 2003 (4), de la Federación Internacional de Diabetes, 2007 (8) y en Venezuela se cuenta con el Consenso Nacional, 2008 (3). Actualmente existe un sobre diagnóstico del SM en niños, adolescentes y adultos. Es importante recordar que obesidad y SM no son sinónimos (9).
Entre los principales factores de riesgo en los niños y adolescentes se mencionan: Edad de inicio y persistencia de la obesidad, peso bajo y alto al nacer, sedentarismo y el consumo de comidas y jugos industrializados. Entre los antecedentes familiares, cabe destacar la diabetes tipos 1 y 2, cuando uno de los padres es obeso la probabilidad de que el niño también lo sea es de 50% y alcanza 70% cuando ambos padres son obesos; así como también la enfermedad cardiovascular a edades tempranas en familiares de primer grado (6,9,10).
Diversos estudios han reportado que el SM tiene su origen en la infancia, por ello la identificación temprana de los factores de riesgo cardio-metabólico en sus etapas incipientes, justifica la intervención precoz para prevenir su progresión y la aparición de complicaciones (2,11-13).
Existe la hipótesis de que tanto factores ambientales como genéticos participan en la variabilidad a la susceptibilidad de las complicaciones metabólicas mediadas por la obesidad. Los avances en el conocimiento de las variaciones en el genoma humano, han llevado a la identificación de genes que contribuyen a la susceptibilidad de la obesidad y las co-morbilidades asociadas (14). Se considera que el SM es el resultado de la interacción de factores genéticos y ambientales, mediados por mecanismos epigenéticos (14,15); sin embargo hay pocos estudios centrados específicamente en la interacción entre la obesidad y polimorfismos genéticos relacionados directamente con el SM. Aguilera et al en 2013, reportaron que algunos loci pueden tener mayor efecto en los fenotipos metabólicos, modificados por la dieta y otros factores ambientales (16).
Estudios recientes sugieren que la dieta materna y la alimentación neonatal desempeñan un papel fundamental en la aparición a largo plazo de los diferentes componentes del SM, mediados por mecanismos epigenéticos; la malnutrición materna tanto por déficit como por exceso podrían regular la expresión de genes involucrados en la regulación del metabolismo de lipídico y de los carbohidratos. La nutrición en el período postnatal temprano es vital para la salud del adulto por su impacto sobre el desarrollo y función de la microbiota intestinal (17).
Estudios más recientes se han focalizado en la identificación de los criterios diagnósticos que muestran una mayor asociación con el riesgo cardiometabólico en el adulto; en este sentido, investigadores españoles y suecos realizaron un seguimiento longitudinal durante seis años de niños de nueve años. Mediante un análisis factorial confirmatorio estudiaron el Índice síndrome metabólico (MS Index), en éste incluyeron las siguientes variables e indicadores: Circunferencia de cintura (CCi), presión arterial, insulina y la relación entre los valores de triglicéridos y del HDL-colesterol (TG/HDL-c). El índice propuesto mostró una canalización aceptable y predictibilidad del riesgo cardiometabólico durante la infancia y adolescencia en niños y adolescentes suecos y estonianos, en especial en los ubicados en el cuartil superior; la circunferencia de cintura mostró la mayor concordancia y la menor fue con la insulina (18). Los resultados de este estudio tienen gran implicación clínica al considerar el SM como un todo y de esta manera se deberían enfocar las estrategias de prevención y control, en vez de cada componente por separado (18).
Gurka et al utilizaron este mismo tipo de análisis estadístico en adolescentes norteamericanos NHANES (1999–2010) de 12-19 años, el índice (MetS risk score) resultó específico de acuerdo al sexo y etnicidad. Puede ser interpretado en términos de z-scores: media= 0 y SDS= 1, los valores más altos se asociaron a un aumento en el riesgo de SM. Utilizando un análisis de curvas ROC incluyendo los componentes, el índice mostró una mayor sensibilidad para predecir riesgo cuando el valor era ≥ 2, que la encontrada usando los criterios de SM por separado en la población pediátrica de acuerdo a la clasificación del ATP III (19).
Con el propósito de determinar la utilidad de la relación cintura/talla para la identificación del riesgo cardiometabólico, investigadores canadienses realizaron un estudio en niños y adolescentes entre 5 y 18 años pertenecientes al NHANES (1999-2008); consideraron categorías del IMC de acuerdo a la referencia de OMS, 2007: normal, sobrepeso, obesos. Para la relación cintura/talla se consideran valores puntuales independientes de la edad y el sexo: <0,5; 0,5-<0,6; ≥ 0,6. Además determinaron la presión arterial, perfil lipídico, insulina y PCR-us como marcador de inflamación crónica (20).
El SM estuvo ausente en los niños y adolescentes con peso normal y con sobrepeso que tenían valores de cintura/talla < 0,5; mientras que estuvo presente en aquellos con un índice de masa corporal alto y valores de la relación Ci/T 0,5-<0,6 (10%) y este porcentaje se triplicó cuando la relación era igual o mayor a 0,6. Concluyeron que el riesgo cardio-metabólico se incrementó a medida que aumentó la adiposidad central medida por la relación cintura/talla (20).
Un grupo de investigadores de la Universidad de Nueva York conducido por el investigador venezolano Antonio Convit, evaluaron a 111 adolescentes obesos no diabéticos con edades entre 14 y 20 años, aquellos con criterios de síndrome metabólico mostraron menores habilidades aritméticas, del deletreo, atención y flexibilidad mental y mayores probabilidades de un desempeño inadecuado en las evaluaciones cognitivas que sus pares saludables. Tenían menores volúmenes del hipocampo, el cual podría estar afectado en estadios pre diabéticos, y dar lugar a complicaciones cerebrales a corto plazo. Los investigadores concluyeron que aunque la obesidad puede no ser suficiente para “poner en acción” a los padres y a veces a los mismos médicos, los resultados de este estudio apelan a realizar intervenciones tempranas y proponen que la función cerebral sea introducida entre los parámetros a ser evaluados cuando se considere un tratamiento precoz de la obesidad infantil (21).
El retardo en el crecimiento fetal junto con un crecimiento postnatal acelerado actúan en forma sinérgica, más evidente en los niños pretérmino y a término nacidos pequeños para la edad gestacional (PEG). La velocidad de peso durante los dos primeros años de vida y un crecimiento acelerado desempeñan un papel importante en la etiología de la adiposidad central, ligada a respuestas metabólicas causantes de resistencia a la insulina y cambios metabólicos en la glicemia y en el perfil lipídico. De modo tal que estos mecanismos en conjunto, explican el mayor riesgo de enfermedad cardiovascular y SM en los pretérmino PEG que posteriormente presentan sobrepeso y tienen menor capacidad para adaptarse a condiciones metabólicas adversas (22-25).
Estudios epidemiológicos recientes de Rotteveel et al han reportado en niños nacidos pretérmino un mayor riesgo de hipertensión arterial (HTA) y resistencia a la insulina en la vida adulta. Se evaluaron adultos jóvenes de 19 años, la prevalencia de HTA fue mayor en los
nacidos pretérmino antes de las 32 semanas y con peso al nacer < 1500 gramos que en los nacidos a término; sin embargo, el perfil lipídico no mostró diferencias entre ambos grupos (26,27). Estos autores encontraron resistencia a la insulina en adultos jóvenes nacidos pretérmino con peso muy bajo al nacer; sin embargo no encontraron asociación significativa entre valores de triglicéridos, colesterol total HDL-colesterol en los nacidos pretérmino o con peso muy bajo al nacer (27).
Por el contrario, Lapillonne en 2013 reportó que la velocidad de peso entre el nacimiento y los 12-18 meses de edad en niños nacidos pretérmino no tenía efecto significativo sobre el comportamiento de la presión arterial y en la aparición del SM en la edad adulta, mientras que el crecimiento a partir de esta edad, parece ser el mejor determinante de las condiciones metabólicas en etapas posteriores de la vida, esto sugiere que una adecuada intervención nutricional durante este período podría ser efectiva (28).
La ingestión alimentaria materna de los ácidos grasos ώ-3 y ώ-6 en la gestación y durante el período de lactancia determinan las cantidades y los tipos de ácidos grasos ώ-3 y ώ-6 transferidos a través de la placenta, secretados en la leche materna y acumulados en los tejidos de los niños en fase de desarrollo.
De acuerdo a los resultados de estudios recientes de Novak et al, se ha planteado que un suministro bajo de ácidos grasos ώ -3 y un suministro elevado de ácidos grasos ώ -6 durante el desarrollo inicial, se asocia a características posteriores del SM, como dislipidemias, resistencia a la insulina e hiperfagia. Debe prestarse atención adicional a la posibilidad de que los ácidos grasos ώ -3 y ώ -6 en el comienzo de la vida produzcan efectos que se extienden, más allá de sus funciones en el desarrollo neural y visual, a funciones complejas en el metabolismo energético, con implicaciones para la propensión al SM (29).
En niños y adolescentes obesos se ha descrito un adelanto fisiológico de indicadores de maduración sexual y ósea (30). En niñas, se ha reportado que el aumento de grasa corporal afecta la regulación hormonal durante la pubertad, con un aumento de la actividad de la aromatasa y una mayor conversión de andrógenos en estrógenos, lo cual puede promover un desarrollo mamario temprano (31). En los niños y adolescentes obesos se ha reportado una edad ósea adelantada hasta los 14 años, sin embargo, usualmente se encuentra normal a partir de esta edad (32).
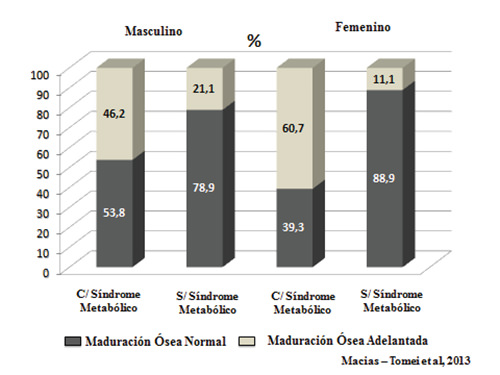
Hasta el presente se carece de información acerca del comportamiento de los indicadores de maduración sexual y ósea en los obesos con criterios diagnósticos de SM. En un estudio realizado en una muestra de 100 niños y adolescentes obesos prepúberes y púberes entre 9 y 16 años con y sin criterios de SM, se evaluó mediante inspección clínica la maduración sexual de acuerdo a estadios de maduración sexual de genitales y glándula mamaria (33-35). A cada uno se le realizó edad ósea evaluada mediante el Atlas de Maduración Ósea del Venezolano (36). En los niños y adolescentes de uno y otro sexo con criterios de SM, el porcentaje de adelanto de la maduración ósea resultó significativamente mayor que en el resto de obesos sin SM, en especial en el sexo femenino (Macías-Tomei, et al 2013. Comunicación personal).
No existe tratamiento global para el SM, es necesario tratar cada uno de los componentes que estén presentes y especialmente, realizar la prevención de los que aún no se hayan desarrollado (3,9). Múltiples estudios han demostrado que el ejercicio físico por sí solo, puede modificar favorablemente el perfil lipídico en niños y adolescentes, ya que la etapa de la niñez es la mejor época para intervenir y evitar la hiperlipidemia, recomendando modos de vida saludables para que se mantengan a largo plazo (11,37,38).
El manejo inicial incluye la dieta y el ejercicio, varios agentes farmacológicos, son una alternativa para los casos más extremos (39); pero cada vez se observa con mayor frecuencia el uso de medicamentos como la metformina.