Cronobacter sakazakii (C. sakazakii) es un microorganismo perteneciente a la familia Enterobacteriaceae asociado con patologías como meningitis y septicemia en recién nacidos. Las fórmulas lácteas infantiles (FLI) han sido reconocidas como el vehículo más importante de transmisión de C. sakazakii, por condiciones inadecuadas durante su producción o preparación. El objetivo de la presente investigación fue evaluar el efecto de la temperatura de refrigeración y el calentamiento de las FLI en el crecimiento de C. sakazakii. Las muestras de FLI reconstituidas se contaminaron con 102, 104 y 106 UFC/mL de C. sakazakii y se refrigeraron durante cuatro horas a 4°C, 6°C y 10°C, posterioriormente, se calentaron en baño hidrotérmico hasta 37°C. Las muestras fueron sembradas al tiempo “0” (postrefrigeración) y luego del calentamiento hasta 37°C en placas con agar cromogénico y se incubaron a 35°C por 24h. Para el análisis de los datos se utilizó la prueba de Wilcoxon. Según los datos obtenidos no hubo variación significativa en la población de C. sakazakii en las FLI luego de 4 horas en refrigeración a 4°C, 6°C y 10°C; sin embargo, al calentar las fórmulas hasta 37°C, hubo en todos los casos una reducción de un ciclo logarítmico en la población de C. sakazakii con un valor de p = 0.0056 y Z= 2.752. Se concluye que el calentamiento a 37°C post-refrigeracion de las muestras, disminuye la población de C. sakazakii en FLI (p<0,05). An Venez Nutr 2013; 26(2): 106-111.
Palabras clave: Cronobacter sakazakii, fórmula láctea infantil, refrigeración, calentamiento
Cronobacter sakazakii (C. sakazakii) is a microorganism belonging to the family Enterobacteriaceae associated with diseases such as meningitis and sepsis in newborns. The powdered infant formula (PIF) have been recognized as the most important vehicle of transmission of C. sakazakii, by inadequate conditions during production or during its preparation. The aim of this investigation was to assess the effect of the cooling temperature and the heating of PIF in the growth of C. sakazakii. For this, PIF reconstituted samples were contaminated with 102, 104 and 106 CFU / mL of C. sakazakii and refrigerated for four hours at 4 ° C, 6 ° C or 10 ° C after this hydrothermal bath heated to 37 ° C. Samples were cultured at time “0” (after- cooling) and then heating to 37 ° C in chromogenic agar plates and incubated at 35 ° C for 24h . For data analysis we used the Wilcoxon test. According to the data there was no significant variation in the population of C. sakazakii in PIF after 4 hours in the refrigerator at 4 ° C, 6°C and 10 ° C , however , by heating the formulas to 37 ° C , in all cases there was a reduction of one log cycle in population C. sakazakii with a value of p = 0.0056 and Z = 2.752 . We conclude that heating at 37°C post- cooling of the samples, decreases the population of C. sakazakii in FLI ( p < 0,05 ) An Venez Nutr 2013; 26(2): 106-111.
Key words: Cronobacter sakazakii, powered infant formula, refrigeration, heating.
1Escuela de Ciencias Biomédicas y Tecnológicas. Universidad de Carabobo. 2Instituto de Ciencia y Tecnología de Alimentos, Universidad Central de Venezuela. 3Escuela de Bioanálisis, Universidad de Carabobo. 4Departamento de Microbiología, Universidad de Carabobo.
Solicitar correspondencia a: Maribel Petrola. e-mail: maribelpetrola@hotmail.com
Cronobacter sakazakii (C. sakazakii) es un microorganismo perteneciente a la familia Enterobacteriaceae. Se caracteriza por ser un bacilo Gram negativo, con motilidad perítrica y no esporulado. Este microorganismo fue llamado inicialmente Enterobacter cloacae productor de pigmento amarillo; sin embargo, para el año 1980 se clasificó como Enterobacter sakazakii, sobre la base de diferencias obtenidas mediante pruebas de hibridación de ADN, reacciones químicas, producción de pigmento y susceptibilidad a antibióticos, con respecto a Enterobacter cloacae. En el año 2007, fue reclasificado como un nuevo género, “Cronobacter”, originalmente con seis especies (C. sakazakii, C. malonaticus, C. turicensis, C. muytjensii, C. dublinensis and C. genomospecies) (1). Sin embargo, recientemente fue identificada una nueva especie (C. condimenti) y además, en la actualidad, C. universalis reemplaza a C. genomospecies 1 (2,3).
C. sakazakii es una bacteria patógena oportunista asociada con una serie de enfermedades graves, tales como: meningitis, enterocolitis necrosante, septicemia, y abscesos cerebrales, con una tasa de mortalidad que oscila entre 40 y 80% (4,5). Esta bacteria ha sido aislada de diversos ambientes, bien de origen industrial u orgánico, incluyendo alimentos tanto animales como vegetales, tanto en su forma natural como deshidratados (6, 7, 8), entre los cuales se pueden señalar las fórmulas lácteas infantiles (FLI), quienes han sido reconocidas como el vehículo más importante de infección por C. sakazakii, especialmente en hospitales, ya que, generalmente, en estos últimos, se preparan simultáneamente todas las fórmulas que se administrarán conforme a la prescripción diaria, aunado al hecho que las instrucciones de preparación no siempre son seguidas correctamente (9,10).
En los últimos años ha existido un aumento en el número de casos reportados de infecciones asociadas a C. sakazakii (7). En este sentido, se han publicado varios trabajos en donde C. sakazakii es responsable de infecciones severas en servicios pediátricos de hospitales con confirmación de la presencia de este germen como agente causal. En Francia (2004), quince recién nacidos infectados (dos casos mortales), cuya fuente de infección confirmada fue la fórmula láctea utilizada contaminada con C. sakazakii (11). En Nueva Zelanda, otro caso de infección por C. sakazakii, donde el microorganismo produjo la muerte de un niño hospitalizado alimentado con leche de fórmula. En el 2007, en Bilbao, España, se reportó un caso de sepsis neonatal por C. sakazakii, y aunque no se pudo demostrar claramente la fuente de infección, el recién nacido fue alimentado con fórmula líquida (12). En Estados Unidos se reportó un brote con cuatro casos de niños recién nacidos infectados por C. sakazakii, de los cuales dos de ellos fallecieron, la investigación acerca de la fuente de infección está siendo procesada por la Administración de Alimentos y Medicamentes FDA. El Centro para el Control y Prevención de Enfermedades (CDC) reportó más recientemente, para el año 2011 un total de doce casos de infección por C. sakazakii en niños) (13).
Sobre esta base se puede observar cómo las FLI han sido un vehículo clave de infección por C. sakazakii. El microorganismo puede ingresar a la fórmula durante el proceso de producción industrial; sin embargo, condiciones inadecuadas tanto en la preparación como en la manipulación de las mismas, pueden exacerbar el riesgo de infección grave, especialmente en recién nacidos prematuros (14,15). En tal sentido, el objetivo de la presente investigación fue evaluar el efecto de la temperatura de refrigeración y el calentamiento de las fórmulas lácteas infantiles reconstituidas, sobre el crecimiento de C. sakazakii.
Muestras. En la presente investigación se utilizaron cinco fórmulas lácteas infantiles de la misma marca comercial y lote, obtenidas comercialmente en la Ciudad de Valencia, Estado Carabobo-Venezuela. De cada una de las fórmulas se obtuvo una muestra.
Cepa de referencia. Se utilizó una cepa de Cronobacter sakazakii (ATCC 5931) proveniente del Laboratorio de Microbiología del Instituto de Ciencia y Tecnología de Alimentos, perteneciente a la Facultad de Ciencias de la Universidad Central de Venezuela, la cual fue conservada en cuñas de agar nutritivo con sucesivos repiques cada siete días.
Verificación de la cepa de referencia. Se realizaron aislamientos de la cepa de C. sakazakii sobre placas con agar cromogénico (Oxoid) para C. sakazakii, con posterior incubación a 35°C por 24 horas. Se observó la morfología de las colonias obtenidas en las placas, se realizó tinción de Gram y se procedió a identificación bioquímica automatizada (bioMérieux Vitek).
Control negativo de las muestras para Cronobacter sakazakii. Se procedió a la determinación de C. sakazakii en las cinco distintas muestras utilizadas de fórmulas lácteas infantiles, previo al inóculo experimental, mediante el método descrito por Iversen y Forsythe (16) empleando Lauril Sulfato Triptosa (Oxoid) modificado con Vancomicina (mLST).
Reconstitución de las fórmulas lácteas infantiles. Las FLI se reconstituyeron con agua destilada estéril (pH 7,0 ± 0,2) a temperatura ambiente (24°C) y siguiendo las indicaciones del fabricante.
Inoculación artificial de las fórmulas lácteas infantiles con Cronobacter sakazakii. Para la contaminación artificial de las unidades experimentales, cada una de las muestras ya reconstituidas se separaron en tres alícuotas de 50 mL para proceder a contaminarlas con los tres niveles de inóculo de C. sakazakii: 102, 104, 106 UFC/mL de fórmula láctea reconstituida; es decir, de la muestra número uno se obtuvieron tres sub-muestras contaminadas con 102, 104, 106 UFC/mL, respectivamente; el mismo procedimiento para las muestras dos, tres, cuatro y cinco.
Efecto de diferentes temperaturas de refrigeración de las fórmulas lácteas infantiles reconstituidas en el crecimiento de Cronobacter sakazakii. Luego de reconstituir las fórmulas infantiles y contaminarlas por separado con los tres niveles de inóculo (102, 104 y 106 UFC/mL), se procedió a refrigerarlas durante 4 horas a tres temperaturas diferentes: 4°C, 6°C y 10°C. Al finalizar el período de refrigeración, se sembró cada ensayo por duplicado en placas con agar cromogénico para C. sakazakii. Las placas fueron incubadas a 35°C por 24 horas.
Efecto del calentamiento (post-refrigeración) hasta 37°C de las fórmulas lácteas reconstituidas en el crecimiento de Cronobacter sakazakii. Al finalizar el período de refrigeración se procedió a calentar cada una de las muestras en baño hidrotérmico, hasta alcanzar una temperatura de 37°C, proceso seguido de la siembra por duplicado de cada alternativa en placas con agar cromogénico para C. sakazakii. Las placas fueron incubadas a 35°C por 24 horas.
Análisis de los datos. Se utilizó la prueba de los signos de Wilcoxon (17), adoptando un nivel de confianza del 95%.
Comprobación de la pureza de la cepa de Cronobacter sakazakii. En la tinción al Gram se observaron bacilos Gram negativos. Se sometió el aislado a una identificación automatizada utilizando el equipo bioMérieux; reportando dicho equipo la pureza de la cepa utilizada.
Control negativo de las muestras para Cronobacter sakazakii. En las cinco muestras de fórmulas lácteas infantiles sin inóculo artificial, no se recuperó Cronobacter sakazakii mediante la metodología Lauril Sulfato Triptosa modificado con Vancomicina (mLST) descrita por Iversen y Forsythe (16).
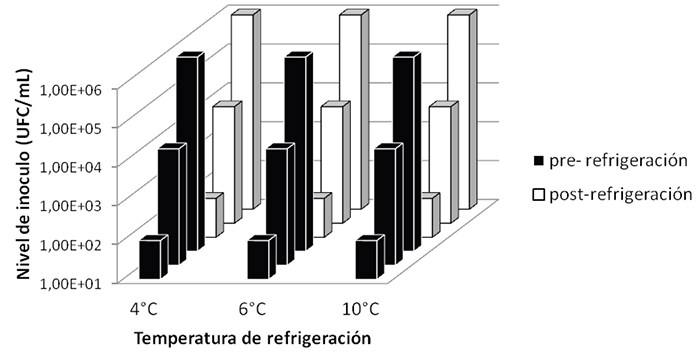
Efecto de diferentes temperaturas de refrigeración de las fórmulas lácteas infantiles reconstituidas en el crecimiento de Cronobacter sakazakii. Como se puede observar en la figura 1, no existió variación en la población de C. sakazakii luego de incubar las FLI contaminadas.
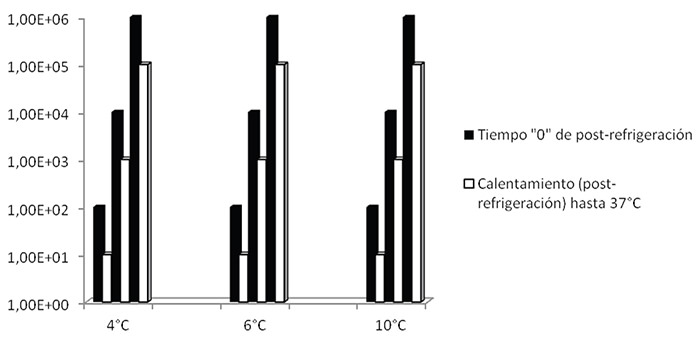
Efecto del calentamiento (post-refrigeración) hasta 37°C de las fórmulas lácteas reconstituidas en el crecimiento de Cronobacter sakazakii. Como se observa en la figura 2, en todas las muestras de FLI reconstituidas, luego de ser calentadas hasta 37°C, se observó una disminución de la carga de C. sakazakii, en todos los casos de un ciclo logarítmico, independientemente del nivel de inóculo utilizado y de la temperatura de refrigeración a la cual fuese sometida la muestra previo al calentamiento. Debido a que posterior al calentamiento de las FLI hasta 37°C se observaron diferencias en la carga de C. sakazakii, se procedió a la aplicación de la prueba de signos de Wilcoxon con un nivel de confianza del 95%. Se obtuvo un valor de p = 0.0056 y un valor de Z= 2.752. Estos resultados estadísticos corroboran la existencia de diferencias estadísticamente significativas sobre la variación de la población de C. sakazakii antes y después de calentar las muestras.
Efecto de la temperatura de refrigeración de las fórmulas lácteas infantiles reconstituidas en el crecimiento de Cronobacter sakazakii. La variación de la temperatura de refrigeración no es un factor que afecta el desarrollo de C. sakazakii en FLI; ya que, luego de refrigerar las fórmulas reconstituidas durante cuatro horas a tres temperaturas de refrigeración diferentes (4, 6 y 10°C) no se obtuvo cambio en la carga bacteriana de dichas fórmulas. Con respecto a este punto, la FAO para el año 2006 publicó que a medida que aumenta la temperatura de refrigeración de la fórmula, existe un incremento en el riesgo de C. sakazakii; sin embargo, el incremento en el riesgo reportado resultó ser mínimo (18). Con respecto a la importancia que tiene la refrigeración de las FLI reconstituidas previo a su consumo, la OMS y la Asociación Americana de Dietética (ADA) recomiendan que cuando se reconstituyen FLI que no van a ser consumidas inmediatamente, deben almacenarse a temperaturas menores de 4 °C (19, 20). De igual manera, Turck en un trabajo publicado en el año 2012, donde considera algunos aspectos de seguridad para la preparación y manipulación de alimentos para niños, recomienda almacenar las fórmulas ya preparadas a temperaturas iguales o menores a 4°C (15). Estas recomendaciones se basan en estudios previos en donde se ha demostrado que la fase de latencia de C. sakazakii, es muy corta, por lo que se hace necesario refrigerar las fórmulas reconstituidas, previo a su consumo si el mismo no es inmediato, y de esta manera evitar el crecimiento de este patógeno (21).
Efecto del calentamiento (post-refrigeración) hasta 37°C de las fórmulas lácteas reconstituidas en el crecimiento de Cronobacter sakazakii. Los resultados obtenidos sugieren que el calentamiento (post-refrigeración) hasta 37°C disminuye el riesgo de C. sakazakii, se obtuvo una disminución de un ciclo logarítmico en la carga del microorganismo, luego de calentar las FLI, independientemente del nivel inicial de inóculo (102, 104 y 106 UFC/mL) y de la temperatura de refrigeración utilizada (4, 6 y 10°C) previo al calentamiento hasta 37°C. Es necesario destacar que con la temperatura de calentamiento utilizada (37°C) no se logró la eliminación de C. sakazakii en las fórmulas; es probable que se requieran temperaturas más elevadas para esto; sin embargo, hay que destacar que el hecho de calentar la fórmula puede producir la pérdida de algunos nutrientes, principalmente de vitaminas (22). De hecho, el Comité de Nutrición de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición, está en desacuerdo con el calentamiento de las fórmulas reconstituidas, debido a los posibles efectos adversos sobre los nutrientes en la fórmula (23). Con respecto al calentamiento de las fórmulas reconstituidas para la eliminación de C. sakazakii, ciertos autores han publicado la importancia de acompañar altas temperaturas con otros métodos preventivos; en este sentido se ha publicado que la utilización de rayos ultravioleta disminuye en forma importante el crecimiento de la bacteria, planteándose el hecho de que los rayos inducen cambios importantes en las macromoléculas bacterianas, como el ADN, proteínas y lípidos además de cambios menores en la composición de la membrana bacteriana (24). Numerosas investigaciones (8, 9, 13, 15) concluyen que la inactivación de C. sakazakii en FLI reconstituidas es fundamental, y dado que las temperaturas capaces de lograr esto son realmente elevadas, alterando la proporción de nutrientes y aumentando el riesgo de quemaduras, se hace necesario la combinación de un conjunto de métodos adicionales efectivos, y de esta manera obtener FLI reconstituidas totalmente inocuas para el consumidor. En la presente investigación se demostró que la temperatura de refrigeración de las FLI no es un factor que afecta el crecimiento de C. sakazakii, así mismo una temperatura de calentamiento postrefrigeración a 37°C, no logró una eliminación total de C. sakazakii en las fórmulas.
Recibido: 18-04-13
Aceptado: 16-10-2013