El objetivo del estudio fue determinar los niveles séricos de zinc en una población rural menor de 15 años del estado Lara-Venezuela, con el fin de conocer las deficiencias en este oligoelemento y emprender a través de los organismos competentes la intervención nutricional. Se estudiaron 310 niños (M:163; F:147) menores de 15 años, con edad promedio de 86,39 meses. El zinc sérico se midió por espectrofotometría de absorción atómica. El nivel sérico de zinc fue de 0,83 ± 0,18 μg/ml. Se observó deficiencia de zinc (valores < 0,72 μg/ml) en 19,7% de los niños, siendo los menores de 2 años los más afectados. Asimismo, se observó un mayor porcentaje de deficiencia de zinc en niños con déficit nutricional seguidos por aquellos que tenían un estado nutricional normal. Al distribuir los deficientes de zinc por grupo de edad y estado nutricional se observó que el 55,6% de los menores de 2 años tenía un estado nutricional normal y otro 44,4% presentó déficit nutricional, mientras que más del 70% de los deficientes de zinc en los grupos de edades de 2-6 y 7-14 años mostraron un estado nutricional normal. Todos los niños con deficiencia pertenecían a familias con pobreza extrema. En vista de las consecuencias negativas que implica la carencia de zinc, es necesario realizar un diagnóstico más preciso de su deficiencia a través de métodos indirectos como el test de tolerancia de zinc o suplementación oral de zinc, para identificar poblaciones en riesgo de deficiencia de zinc. Asimismo, iniciar programas de intervención con este oligoelemento, especialmente en la población infantil vulnerable, como las que aquí habitan. An Venez Nutr 2008;21 (2): 77-84.
Palabras clave: Zinc, pobreza, desnutrición, niño, población rural.
The aim of this research was to determine the levels of serum zinc in a rural population under 15 years old, in Lara State, Venezuela, in order to know the deficiencies of this oligoelement and start the nutritional intervention by the involved organizations. The sample was made up of 310 subjects (M: 163; F: 147) under 15 years old, with an average age of 86.39 months. The serum zinc was measured by atomic absortion spectrophotometry. The serum zinc level was 0.83 ± 0.18 μg/ml. Deficiency of zinc (values = 0.72 μg/ml) was presented in 19.7% of the subjects; the most affected were those under two years old. Likewise, the highest percentage of zinc deficiency was observed in subjects with nutritional deficit followed by those that had a normal nutritional condition. By splitting the group of subjects with zinc deficiencies by age and nutritional condition, it was observed that 55.6% of those under two years old had a normal nutritional condition and the remaining 44.4% showed nutritional deficiency. Meanwhile, more than 70% of the subjects with zinc deficiency belonging to the groups aged 2-6 and 7-14 showed a normal nutritional condition. All the subjects with nutritional deficit belonged to families living in extreme poverty. Due to the negative consecuences that imply the lack of zinc, it is necessary to make a more accurate diagnosis of its deficiency through indirect methods like the zinc tolerance test or oral supplementation of zinc, in order to identify population with risk of zinc deficiencies. Likewise, to start intervention programs with this oligoelement, especially in the vulnerable child population like the one studied. An Venez Nutr 2008;21 (2): 77-84.
Key words: Zinc, poverty, malnutrition, child, rural population.
Nombre del Departamento e Institución a los que se le debe atribuir el trabajo:
Laboratorio de Bioquímica Nutricional. Unidad de Bioquímica. Decanato de Medicina. Universidad Centroccidental “Lisandro Alvarado”.En los últimos años se ha reconocido la importancia del zinc en la salud humana. Es un elemento traza que juega un papel en el crecimiento celular, ya que se requiere para la estructura o actividad de más de 200 enzimas (1,2) que son necesarias para: síntesis de ADN, ARN, procesos de transcripción genética, defensa antioxidante y funcionamiento del sistema inmune. Aunque el mecanismo exacto no está claro, parece que el zinc es necesario en la neurogénesis, la migración neuronal y la sinaptogénesis, por lo que su deficiencia podría interferir en la neurotransmisión y subsiguiente conducta neuropsicológica (3).
Entre los alimentos con alto aporte de zinc están: las carnes rojas, vísceras y mariscos, en general las proteínas animales tienen una elevada biodisponibilidad de zinc por su bajo contenido de fitatos en comparación a las proteínas de origen vegetal (4). La biodisponibilidad del zinc puede ser afectada por factores nutricionales como los fitatos (5) presente en alimentos como cereales y harinas sin refinar. A altas concentraciones de fitatos se genera interacción zinc-fitato que impide la biodisponibilidad del zinc (6).
Se ha reportado que la reducción de fitato en la dieta incrementa sustancialmente la absorción de zinc (7). Algunos aminoácidos como el glutamato, histidina y los aminoácidos sulfurados (metionina y cisteína), al igual que el ácido picolínico (4, 8) incrementan la absorción de zinc.
Por otra parte, la deficiencia de zinc puede estar asociada a un incremento en su pérdida por los procesos de diarrea aguda, recurrente o persistente (9,10). En este mismo sentido, las parasitosis intestinales (11, 12), un estado nutricional de zinc deficiente al momento de nacer (13) y las prácticas inadecuadas de ablactación (14) también constituyen factores condicionantes a la carencia de zinc en niños.
En Venezuela, el patrón alimentario para 1981-1982 aporta evidencia de que generalmente hay una menor ingesta de energía y de alimentos de origen animal en los estratos más pobres de la población. Por otra parte, el consumo de cereales y leguminosas aumenta al desmejorarse la condición socioeconómica y es ligeramente mayor en la población rural con respecto a la urbana. Los cereales preferidos son harina de maíz precocida, el arroz y el pan de trigo; de los tubérculos la papa y la yuca; y en leguminosas las caraotas negras (15), representando la principal fuente de fitatos de la dieta. Asímismo, estudios más recientes de consumo indican que las dietas latinoamericanas de las clases populares favorecen la deficiencia de zinc (16-19) debido al alto consumo de cereales y leguminosas y la baja ingesta de alimentos de origen animal.
El zinc es un metal ubicuo y versátil en el metabolismo subcelular sugiriendo que su deficiencia puede resultar en un daño generalizado de muchas funciones metabólicas (9). Se ha encontrado que la deficiencia de zinc en niños tiene efectos negativos en el crecimiento, la ingesta de alimento, el desarrollo cognitivo, motor y sexual, en la función inmune y en la resistencia al estrés y a las enfermedades (2,3,9,13,20-25). Aunque los micronutrientes se necesitan a cualquier edad, los efectos de una ingesta inadecuada son especialmente graves durante las épocas de crecimiento intenso como el embarazo, primera infancia y lactancia (2,9).
Estudios realizados en diferentes regiones de Venezuela, han permitido detectar deficiencia de zinc en algunas poblaciones de bajo nivel socioeconómico. En el estado Zulia se encontró deficiencia de zinc en 19,6% de la población, principalmente en los grupos etarios de 3 a 7 años y de 19 hasta los 45 años (26). De igual forma, Amaya et al. (27), reportó 38,36% de deficiencia de este micronutriente en niños de 3 meses a 8 años pertenecientes a familias de bajos ingresos de los barrios marginales de la ciudad de Maracaibo. Silva et al. (28) detectó deficiencia de este oligoelemento en 45% de preescolares de la ciudad de Mérida y Solano et al. (19) reportó déficit de zinc en preescolares y adultos mayores en un 38,5% y un 18%, respectivamente. Por otra parte, en países como México, la deficiencia de zinc ha sido considerada como uno de los principales problemas de nutrición pública, con una prevalencia de 33% y 20% en niños menores de 5 años y 5-11 años de edad, respectivamente; siendo más alta esta deficiencia en áreas rurales con respecto a las urbanas (29).
El empobrecimiento de la población venezolana constituye uno de los problemas más difíciles que enfrenta nuestro país, incidiendo negativamente en el consumo de alimentos, especialmente los de origen animal (30,31); lo que compromete el consumo de proteínas de alto valor biológico y de micronutrientes, generando déficit nutricional, con una mayor frecuencia en los estratos socioeconómicos más bajos que habitan en las zonas periurbanas de las grandes ciudades y en los poblados rurales (30), por lo que es posible suponer la existencia de déficit de zinc y sus correspondientes efectos. De allí que el objetivo de la presente investigación fue determinar los niveles séricos de zinc en una población rural menor de 15 años del estado Lara- Venezuela, utilizando como indicador bioquímico el valor sérico del zinc, para identificar los grupos de riesgo a la deficiencia de este micronutriente con el fin de iniciar programas de intervención para resolver ese problema nutricional.
La presente investigación forma parte de un trabajo que realizó el Laboratorio de Bioquímica Nutricional del Decanato de Medicina de la UCLA en los sectores rurales del Municipio Andrés Eloy Blanco (MAEB) del estado Lara y del cual se han publicado los resultado del estado nutricional antropométrico de los niños del sector La Escalera (32).
Estudio descriptivo, de corte transversal en niños y niñas con edades comprendidas entre 3 meses y 14 años de edad de las localidades rurales de San Antonio de Guache y La Escalera del MAEB. Se seleccionaron 310 niños (masculino: 163; femenino: 147) a través del muestreo aleatorio estratificado simple de acuerdo a la edad (< 2, 2-6 y 7-14 años). Previamente se obtuvo el consentimiento informado por escrito de los padres y representantes de los niños. Se excluyeron los niños cuyos sueros se hemolizaron. Para la clasificación por edades se usó la escala que emplea el Ministerio del Poder Popular para la Salud (MPPS) de la República Bolivariana de Venezuela y el Sistema de Vigilancia Alimentaria Nutricional (SISVAN) del Instituto Nacional de Nutrición (INN), que los agrupa en menores de 2 años, 2-6 años y 7-14 años.
A los niños en ayunas se les tomó 5 ml de sangre por punción venosa en el pliegue del codo. La muestra se tomó entre las 7 am y las 9 am para controlar el ritmo circadiano del zinc (33). Se utilizaron jeringas desechables libres de metales.
Para la determinación del zinc las muestras de sangre se tomaron en tubos de vidrio, sin coagulante, que fueron lavados previamente con ácido nítrico al 12% con el fin de eliminar la contaminación con trazas de metales. Las muestras de sangre se dejaron 90 minutos (34) a temperatura ambiente hasta la retracción del coágulo, luego se centrifugaron a 3000 r.p.m. durante 20 minutos y el suero obtenido se almacenó a -20°C en tubos plásticos, lavados previamente con ácido nítrico al 12 % hasta la medición del zinc. Para establecer la deficiencia de zinc se escogió como punto de corte el descrito por Estévez et al (26): < 0,72 ì g/mL. La determinación de zinc se realizó por espectrofotometría de absorción atómica con llama, mediante el método de Smith (35). Se utilizó un espectrofotómetro de absorción atómica PYE UNICAM SP191 (PYE UNICAM Ltd, Cork street Cambridge CBI 2PX England). a unalongitud de onda de 219,3 nm. Se usó un flujo de aire de 5 L/min y de acetileno de 600 mL/min y se ajustó la corriente de la lámpara al valor recomendado por el fabricante.
La concentración sérica de zinc se analizó agrupando a los niños por edad y estado nutricional.
Las mediciones antropométricas fueron realizadas siguiendo las técnicas recomendadas para la evaluación nutricional (36) por un personal debidamente estandarizado. Las variables antropométricas tomadas fueron peso (P) y Talla (T). La calibración de los instrumentos se verificó previo a la medición.
Los niños fueron pesados y medidos en ropa interior y sin zapatos. En los menores de 2 años el peso y la talla se obtuvo por un infantómetro Medinca ® con precisión de 0,02 kg y 0,1 cm y a los niños de 2 y más años de edad, el peso y la talla se midió con una balanza marca Detecto® con precisión de 0,01kg y 0,5cm. La clasificación del estado nutricional se realizó con los indicadores de dimensiones corporales: Peso-Talla (P/T), Talla-Edad (T/E) y Peso-Edad (P/E), así como también la combinación de ellos (37). Se usó el patrón de referencia de la Organización Mundial de la Salud (OMS) y como punto de corte para definir normalidad se estableció un valor menor o igual que el percentil 90 de la referencia y un valor mayor que el percentil 10 para P/T y P/E y que el percentil 3 para T/E (37). Valor superior que el percentil 90 se definió como alto o exceso y valor menor que el percentil 10 para P/T y P/E y que el percentil 3 para T/E, como bajo o déficit.
El nivel socioeconómico de las familias a las cuales pertenecían los niños del estudio, se evaluó a través de la aplicación de dos métodos: Necesidades Básicas Insatisfechas (NBI) (38) y Graffar modificado por Méndez-Castellano (39).
Para investigar parásitos, huevos y quistes en las muestras de heces se realizó según el Método de Kato-Katz Cualitativo (40), previa recolección de las heces en envases plásticos por evacuación espontánea, durante las primeras horas de la mañana.
Se calcularon medidas estadísticas descriptivas (promedio y desviación estándar) de las variables que registraron los niveles séricos de zinc. Se aplicó el Test de Shapiro Will para verificar la distribución normal de la variable nivel sérico de zinc y algunas variables antropométricas. Se utilizó la Prueba de Levene para verificar homogeneidad de varianza previo al Anova de una vía y la Prueba de Scheffe (aplicada cuando los tamaños muestrales entre los grupos son diferentes) para comparar las medias entre las concentraciones sérica de zinc. Se construyeron modelos de regresión lineal para verificar la relación entre algunas variables con los niveles séricos de zinc y modelos de regresión logística para describir asociación entre algunas variables, así como también para calcular las probabilidades y los riesgos relativos (1/ 1+e-2) de un niño a presentar deficiencia de zinc considerando factores como la edad, parasitosis intestinal y estado nutricional. En todas las pruebas se utilizó un nivel de significación de p<0,05. Los resultados fueron expresados como promedios ± desviación estándar y porcentajes.
La edad promedio del grupo de niños menores de 2 años fue de 12,5 meses, en el grupo etario de 2-6 años y 7-14 años fue de 54,8 y 120,99 meses, respectivamente. Los resultados de los niveles séricos de zinc en la población rural estudiada se muestran en la Cuadro 1. El valor promedio de zinc sérico fue de 0,83 ± 0,18 ì g/mL. Al discriminar este resultado por grupo de edad no se encontraron diferencias significativas entre los grupos y los valores promedio estuvieron por encima del punto de corte establecido para la deficiencia de zinc. Asimismo, cuando se evaluaron las concentraciones séricas de zinc por sexo, los valores promedio fueron de 0,82±0,20 ì g/mL y 0,84±0,17 ì g/mL para el sexo masculino y femenino, respectivamente, y sin diferencias estadísticamente significativas. No se encontró correlación alguna entre los niveles séricos de zinc con la edad (p. 0,043) y el sexo (p. 0,046).
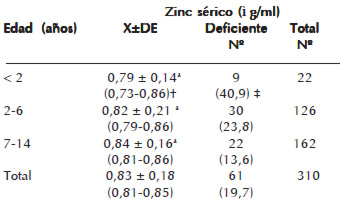
Para definir el estado de déficit de zinc se consideró como punto de corte un valor sérico de este oligoelemento <0,72 ì g/mL. De acuerdo con esta cifra 19,7% de los niños presentó deficiencia de zinc (concentración promedio de 0,62 ± 0,11 ì g/mL) (Cuadro 1), siendo los niños menores de 2 años los más afectados. Al construir el modelo de regresión logística para la deficiencia de zinc y edad, se observó que el valor de p asociado al coeficiente de la variable edad es altamente significativo (p -0,02) y con signo negativo, lo cual indica que a medida que aumenta la edad disminuye el riesgo de un niño(a) a ser deficiente de zinc. Al aplicar este modelo a la variable parasitosis intestinal no se reportó efecto significativo de la misma sobre la deficiencia de zinc (p 0,764).
Los niños con deficiencia de zinc pertenecían a familias pobres, en su mayoría con Pobreza extrema (82% y 96% según Graffar Méndez-Castellano y NBI (Necesidades Básicas Insatisfechas), respectivamente).
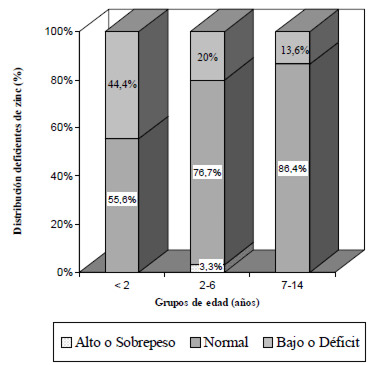
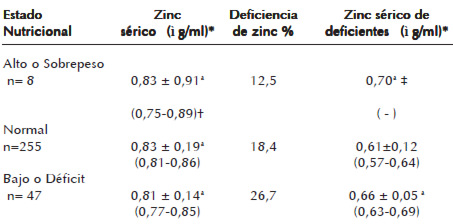
Los valores promedio de zinc para los diferentes estados nutricionales se ubicaron por encima de 0,72 ì g/mL, sin diferencias estadísticamente significativas (Cuadro 2). Se observó un mayor porcentaje de deficiencia de zinc en niños con déficit nutricional seguidos por aquellos que tenían un estado nutricional normal (Cuadro 2). Asimismo, al distribuir los deficientes de zinc por grupo de edad y estado nutricional (Figura 1), se observó que el 55,6% de los menores de 2 años tenía un estado nutricional normal y otro 44,4% presentó déficit nutricional, mientras que más del 70% de los deficientes de zinc de los grupos etarios de 2-6 y 7-14 años mostraron un estado nutricional normal (Figura 1). Los cálculos de probabilidad indican que el riesgo a ser deficiente de zinc de un niño con déficit nutricional es aproximadamente el doble (RR 1,68: p 0,27/0,16) con respecto a un niño con estado nutricional normal. Debido al efecto que tiene el zinc sobre el crecimiento, se correlacionó los niveles séricos de zinc con la talla, no mostrando relación alguna ambas variables (p. 0,059).
La concentración promedio de zinc encontrada en el presente estudio es similar a la reportada en otros estudios en diferentes regiones del país como el estado Zulia en una población de bajos recursos socioeconómicos (26) y en estudio de otros países en niños de 2 años (41). Sin embargo, el valor en el presente trabajo supera a los reportados por Silva et al. y Brunetto et al. (28, 42) en niños de zonas rurales del estado Mérida, y a la de niños de zonas marginales del estado Zulia (27) y son inferiores a aquellos encontrados en niños de una zona rural del África (Ghana) (43). Los niveles plasmáticos de zinc responden en gran medida a estímulos externos como son las fluctuaciones en la ingesta de zinc, el ayuno y diversos tipos de estrés agudo, por ejemplo las infecciones, entre otros, (4) lo que podría incidir en las concentraciones séricas del zinc y explicar la diferencia de estas concentraciones, en individuos de diferentes países, de regiones de un país, incluso entre individuos de una misma zona o localidad.
Al dividir la población en estudio por grupo de edad, se observó que la muestra fue poco representativa en los menores de 2 años por su pequeño número. Sin embargo, el nivel de zinc sérico de este grupo fue más bajo con respecto a los grupos de edades de 2-6 años y 7-14 años. Similar comportamiento lo reporta Amaya et al. (27) donde los niños menores de 3 años en promedio tenían 76,6 ± 19,22 μg/dL de zinc plasmático y los grupos de edades mayores a 3 años valores por encima de 80 μg/dL. En este sentido, otras investigaciones (28,38) muestran que los niveles séricos del zinc fueron más bajos en niños de 2 años con respecto a los grupos de niños de 3 a 6 años de edad.
Uno de los factores que pudiese explicar este hallazgo es la lactancia materna, ya que la misma no garantiza un adecuado aporte de zinc debido a que la concentración de este micronutriente en la leche materna es alta sólo en el calostro y va disminuye en el tiempo (44). Por otra parte, el rápido crecimiento de los niños menores de 2 años, demanda una mayor cantidad de zinc debido a la participación del mismo en la síntesis de ácido nucleico y replicación celular (2), no permite que la ingesta promedio de zinc por leche materna, cubra los requerimientos, tal como lo reporta un estudio (14) donde la leche materna cubrió 40%-45% del requerimiento nutricional en niños de 6-8 meses de edad, a pesar de que el aporte de zinc fue mayor con respecto a los alimentos complementarios. Asimismo, los alimentos ofrecidos durante la ablactación, constituyen un factor importante en el aporte de zinc.
En este sentido, aunque no se realizó un estudio de consumo para conocer la calidad y cantidad de la alimentación de la población en estudio, es probable que los requerimientos de zinc no se hayan cubierto con la ingesta alimentaria, ya que las condiciones socioeconómicas en las cuales vive esta población, por una parte, impide la ingesta de alimentos ricos en zinc como lo son los de origen animal (4,23,45), así como también hace que la población infantil sea más propensa a procesos infecciosos como la diarrea y presencia de parasitosis (6,9,11,18,46) afectando la biodisponibilidad del zinc o aumentando su excreción, lo que genera una disminución en las reservas de zinc, reflejándose en sus valores séricos. Las condiciones antes mencionadas, también podrían explicar la mayor prevalencia de deficiencia de zinc en los menores de 2 años.
La deficiencia de zinc de toda la población en estudio es similar a la reportada por Estévez et al. (19,6%) (26) en una población suburbana de 2-70 años, pero fue 15%- 20% más baja con respecto a la reportada por otros autores en niños de 3 meses-8 años con bajo nivel socioeconómico de de una zona marginal del estado Zulia (27) y niños de 2-6 años del estado Mérida (28,42). Además de un déficit en la ingesta de zinc, procesos infecciosos y parasitosis, otros factores podrían estar relacionados con la deficiencia de zinc encontrada en el presente estudio, como lo es, el consumo de alimentos con alto contenido de fitatos (cereales y leguminosas) que afectan la biodisponibilidad del zinc (5) y que se ha reportado en estudios de consumo en países centroamericanos (México, Guatemala) (16,19) y suramericanos (Venezuela) (18) son principal fuente de energía en poblaciones de bajo nivel socioeconómico.
Los niveles séricos de zinc en los niños de 2-6 años y 7-14 años más altos con respecto a los menores de 2 años, reportados también por otros investigadores (28,42), probablemente se deba a una mayor variedad en el aporte de alimentos o la menor incidencia de procesos infecciosos, como la diarrea aguda(4,9), evitando la pérdida del zinc del organismo. Por esto se observó menor prevalencia de deficiencia de zinc en estos grupos de edades con respecto a los menores de 2 años, lo que podría explicar que a medida que aumenta la edad disminuye el riesgo de un niño a ser deficiente de zinc.
Al igual que lo indican otros trabajos (26,27,47) no se encontró diferencias significativas en la concentración sérica de zinc con respecto al sexo.
En relación al estado nutricional, gran parte de los niños con deficiencia de zinc tenían déficit nutricional. Igual resultado lo reporta Amaya et al. (27) en niños zulianos de bajo nivel socioeconómico, aunque fue mayor la prevalencia de niños con deficiencia de zinc y déficit nutricional (41%) y niños con estado nutricional normal (33,89%). Por otra parte, los niveles séricos de zinc de los niños con déficit nutricional del presente estudio, fueron más bajos con respecto a los normales. Igual comportamiento lo reportan estudios realizados en Venezuela (27, 28, 48) y en otros países (43). Sin embargo, los valores aquí encontrados se asemejan a los de Amaya et al. (27) y Silva et al. (28), mientras que superan a los descritos por Amesty et al. (48) y son inferiores a los reportados por Takyi y Asibey (43).
La alimentación que puede caracterizar a esta población por su bajo nivel socioeconómico (16,18,19) podría comprometer la ingesta calórica-proteica y de micronutrientes como el zinc (4, 23, 45), generando pérdida del apetito (4), como una de las consecuencias a la deficiencia leve o severa de este micronutriente, por lo que el estado nutricional de un individuo se puede ver afectado, incidiendo fundamentalmente en un retardo en el crecimiento (2, 13), generando déficit nutricional. Por otra parte, hay evidencias de que la deficiencia de zinc puede ser generalizada, incluso en poblaciones que están bien nutridas (13) lo que pudiera explicar el hecho de que niños antropométricamente normales del presente estudio presentaron deficiencia de zinc sérico.
El déficit nutricional que supone una disminución en los mecanismos de defensa inmune, conduce a una mayor susceptibilidad a infecciones, especialmente la diarrea (9,46) generando mayor pérdida de zinc. Asimismo, la mayor demanda de zinc de individuos en periodos de crecimiento (2,9), podrían explicar que más del 40% de los niños con deficiencia de zinc y déficit nutricional del estudio, fueron los menores de 2 años.
La deficiencia de zinc afecta negativamente el desarrollo intelectual y sexual, así como también, genera un moderado retardo en el crecimiento, hasta un franco enanismo además de la pérdida del apetito, letargia, hipogonadismo, lesiones dérmicas, alteración inmune, procesos infecciosos disminución de los niveles séricos, entre otros (21-24). En conjunto, se reflejará en un deteriorado desarrollo físicomental de los niños y futuros adultos, mermando su calidad de vida y por ende el desarrollo de la nación. En vista de las consecuencias negativas que implica la carencia de zinc, es necesario realizar un diagnóstico más preciso de su deficiencia a través de métodos indirectos como el test de tolerancia de zinc (49) o suplementación oral de zinc (50), para identificar poblaciones en riesgo de deficiencia de zinc. También se hace necesario, realizar estudios de consumo que permitan conocer la ingesta de este micronutriente y de otros factores nutricionales que pudieran incidir en su deficiencia. Por otra parte, se precisa, iniciar programas de intervención con este oligoelemento por parte de los organismos competentes, especialmente dirigidos a poblaciones infantiles vulnerables como lo son aquellas que habitan en zonas rurales.
Nuestro agradecimiento al Consejo de Desarrollo Científico, Humanístico y Tecnológico de la Universidad Centroccidental “Lisandro Alvarado” por su apoyo económico. A Luli González por su profesionalismo y dedicación, a la Alcaldía del Municipio Andrés Eloy Blanco por su valiosa y oportuna colaboración para la alimentación de los niños durante la realización de este trabajo. Igualmente queremos agradecer a todos los niños y representantes de los caseríos de San Antonio de Guache y La Escalera que participaron en la presente investigación, ya que sin ellos este trabajo no se hubiese realizado.
Recibido: 14-12-2007
Aceptado: 08-07-2008